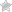Роль воды в клетке для живого организма незаменима. Она составляет около 70 процентов от её массы. Остальные 30 процентов занимают органические и неорганические вещества. Недостаток жидкости приводит к истощению или гибели организма.
В данной статье мы узнаем, какие важные функции вода выполняет в клетках.
Какую роль выполняет в клетке вода
Все живые организмы состоят из клеток: человек, растения, животных, бактерии и т.д.
Клетка – это наименьшая единица строения живого организма. Они различаются, но имеют общие признаки.
Источник: Биология, Л.Н Сухорукова, В. С. Кучменко, И. Я. Колесникова
В состав всех клеток входят органические и неорганические вещества. Самое распространенное неорганическое вещество – вода.
Рассмотрим кратко её основные функции.
- Растворитель. Вода выполняет в клетке функцию растворителя, большинство химических реакций протекают только в водной среде.
- Транспортная функция. Помогает переносить питательные вещества из одной части в другую.
- Функция регенерации. С помощью воды удаляются ненужные продукты жизнедеятельности.
- Вода как реагент. Она участвует во многих химических реакциях: полимеризации, гидролиза, в процессе фотосинтеза.
- Терморегуляторная. Поглощает большое количество тепловой энергии при минимальном повышении собственной температуры. Таким образом, защищает организм от перегрева и обеспечивает равномерное распределение тепла по всему организму.
- Придает форму и упругость клетке. Вода практически не сжимается (в жидком состоянии) и служит гидростатическим скелетом. В составе клетке вода занимает 1 место среди всех химических соединений, определяет объем и упругость.
Химическая роль
Вода в качестве реагента участвует во многих химических реакциях:
- фотосинтеза растений;
- гидролизе – разрушении веществ с присоединением воды.
Химический состав клетки
Рассмотрим полный состав на рисунке № 2.
Химический состав
Органические вещества
- Белки – сложные органические соединения. В одном организме может быть несколько тысяч разных видов. Самый известный белок — гемоглобин. Он осуществляет поступление кислорода ко всем клеткам. Благодаря белку Интерферону, организм человека борется с вирусными заболеваниями.
- Углеводы необходимы, как источник энергии.
К ним можно отнести: глюкозы, сахарозу и д. р.
- Жиры являются запасным источником энергии и воды. Особенно они важны для животных, впадающих в спячку.
- Нуклеиновые кислоты – высокомолекулярные соединения. Присутствуют во всех живых организмах. Передают наследственную информацию.
Они хорошо растворимы в воде, практически нерастворимы в органических растворителях.
Неорганические вещества
- Вода занимает 70 процентов. Она является непосредственным участником роста, размножения, питания, выделения, передвижения веществ в клетке и организме.
- Минеральные соли, растворены в воде. Составляют от 1-1,5 процентов. В растворенном виде они образуют необходимую среду для химических процессов.
- Углекислый газ.
- Кислоты и основания.
Как образуются органические и неорганические вещества
В природе большое разнообразие клеток. Они могут отличаться размерами, функциям, формой. Могут быть свободноживущими или входить в состав многоклеточного организма. При всем многообразии они состоят из одних и тех же типов химических веществ.
Живую клетку отличают 2 особенности:
- высокое содержание воды;
- большое количество сложных органических веществ.
По подсчетам ученых в ней можно встретить около 70 химических элементов, правда, только 24 встречаются постоянно. Рассмотрим рисунок № 3.
По количеству элементы, содержащиеся в клетках, делят на 3 группы.
- Макроэлементы. Встречаются в большом количестве. К ним относят: Кислород, Углерод, Водород, Азот, Серу, Железо, Фосфор, Кальций и т.д.
- Микроэлементы. Встречаются в небольшом количестве такие элементы, как: Марганец, Медь, Кобальт, Цинк и т.д. Несмотря на малое содержание, они выполняют большую роль в обмене веществ.
- Ультрамикроэлементы. Составляют менее 0, 000001 % в организме живых существ. К ним относятся: Золото, Серебро, Платина, Цезий, Селен и т. д.
Процентное содержание элементов не характеризует их важность в организме. Многие элементы входят в состав биологически важных веществ, ферментов, витаминов. Например, Кобальт входит в состав Витамина В12.
Эти 70 элементов могут входить в состав клетки. Они образуют 1000 химических веществ, которые можно разделить на неорганические и органические вещества.
Вода в органах и тканях
Всем живым существам необходима вода. Тело человека состоит из воды на 60-80 процентов. Она необходима каждому органу: коже, головному мозгу, желудку, сердцу, зубной эмали, ногтям и т.д.
При недостатке жидкости происходит обезвоживание организма. В клетке человека в разных органах и тканях содержится разное количество воды.
Для наглядности представлен рисунок № 4.
Примечательной особенностью является то, что с возрастом в теле человека становится меньше жидкости.
Например, у новорожденного — 80 процентов жидкости, у пожилого человека — 60 процентов.
Функции свободной воды в бактериальных клетках
Вода в клетках живых организмах бывает двух видов.
- Свободная, входит в состав цитоплазмы, заполняет межклеточные пространства, заполняет сосуды, пространства между органами. Она нужна для транспортировки веществ и для поддержания процессов жизнедеятельности
- Связанная, входит в состав клеточных структур (например, белков, мембран).
Основных различием бактериальной клетки является отсутствие ядра. Вместо него в центральной части находится ядерное вещество, которое выполняет такие же функции. Рассмотрим рисунок № 5.
Бактериальная состоит из 80-90 процентов воды, 10 процентов приходится на долю сухого вещества.
Свободная вода в ее составе выполняет функции:
- растворителя;
- транспортировки;
- обеспечивает процессы метаболизма;
- способствует размножению.
Существуют организмы, не имеющие клеточного строения. К ним относят вирусы.
Заключение
В жизнедеятельности клетки вода выполняет ключевую роль. Её содержание не редко достигает 70-80 процентов. Вода необходима для каждого процесса в живом организме и содержится в каждом органе. Вода – источник жизни, ее биологическая роль бесценна для живого организма.
вода в клетке роль воды в клетке строения клеток
Вам также может понравиться
Неорганические соединения
Вода* Самое распространенное неорганическое соединение в живых организмах — вода. Ее содержание колеблется в широких пределах: в клетках эмали зубов воды около 10%, а в клетках развивающегося зародыша — более 90%. В среднем в многоклеточном организме вода составляет около 80% массы тела.
Роль воды в клетке очень велика. Ее функции во многом определяются химической природой. Дипольный характер строения молекул обусловливает способность воды активно вступать во взаимодействие с различными веществами.
Ее молекулы вызывают расщепление ряда водорастворимых веществ на катионы и анионы. В результате этого ионы быстро вступают в химические реакции.
Большинство химических реакций представляет собой взаимодействие между растворимыми в воде веществами.
Таким образом, полярность молекул и способность образовывать водородные связи делают воду хорошим растворителем для огромного количества неорганических и органических веществ.
Кроме того, в качестве растворителя вода обеспечивает как приток веществ в клетку, так и удаление из нее продуктов жизнедеятельности, поскольку большинство химических соединений может проникнуть через наружную клеточную мембрану только в растворенном виде.
Не менее важна и чисто химическая роль воды. Под действием некоторых катализаторов — ферментов — она вступает в реакции гидролиза, т. е. реакции, при которых к свободным валентностям различных молекул присоединяются группы ОН” или НГ воды. В результате образуются новые вещества с новыми свойствами.
Вода в известной степени является теплорегулятором; за счет хорошей теплопроводности и большой теплоемкости воды, при изменении температуры окружающей среды, внутри клетки температура остается неизменной или ее колебания оказываются значительно меньшими, чем в окружающей клетку -. среде.
Минеральные соли. Большая часть неорганических веществ клетки находится в виде солей — либо диссоциированных на ионы, либо в твердом состоянии. Среди первых большое значение имеют катионы К+.
Na+, Ca2+, которые обеспечивают такое важнейшее свойство живых организмов, как раздражимость. В тканях многоклеточных животных кальций входит в состав межклеточного «цемента», обусловливающего сцепление клеток между собой и упорядоченное их расположение в тканях.
От концентрации солей внутри клетки зависят буферные свойства клетки.
молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае –пептидными связями:
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот — трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, — полипептидом.
Аминокислоты имеют общий план строения, но отличаются друг от друга по строению радикала (R), которое весьма разнообразно. Например, у аминокислоты аланина радикал простой — СНз, радикал цистеина содержит серу — CH2SH, другие аминокислоты имеют более сложные радикалы.
Белки, выделенные из живых организмов животных, растений и микроорганизмов, включают несколько сотен, а иногда и тысяч комбинаций 20 основных аминокислот. Порядок их чередования самый разнообразный, что делает возможным существование огромного числа молекул белка, отличающихся друг от друга.
Например, для белка, состоящего всего из 20 остатков аминокислот, теоретически возможно около 2×10 вариантов, отличающихся чередованием аминокислот, а значит, и свойствами различных белковых молекул. Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация.
Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали {а- структура) или сладчатого слоя «гармошки» (/?- структура). Это вторичная структура белка (рис.
3.1, 3.2).
Буферноетыо называют способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне. Буферные растворы характеризуются тем, что внесение в них или образование в процессе обмена веществ небольших количеств кислоты или щелочи не оказывает влияния на значения рН вследствие образования соединений с карбонатами, фосфатами или органическими молекулами. Внутри клетки буферность обеспечивается главным образом анионами Н2РО4″. Во внеклеточной жидкости и в крови роль буфера играют Н2СО3″ и НСОз “. Анионы слабых кислот и слабые щелочи связывают ионы водорода (НГ) и гидроксил-ионы (ОН”), благодаря чему реакция внутри
клетки практически не меняется.
Нерастворимые минеральные соли, например фосфорнокислый кальций, входят в состав межклеточного вещества костной ткани, в раковины моллюсков, обеспечивая прочность этих образований.
Неорганические вещества клетки. Вода, соли, их роль в жизнедеятельности клетки
Большинство химических соединений, которые входят в состав клетки, встречаются только в живой природе. Почти все молекулы за небольшим исключением, встречающиеся в клетке, относятся к соединениям углерода и рассматриваются в курсе органической химии.
Однако вода встречается и в живой, и в неживой природе. В среднем почти 70% от массы живых организмов составляет вода. Но содержание воды в клетке может колебаться в зависимости, например, от ее конкретного вида или возраста.
Помимо воды в клетках в значительных количествах встречаются некоторые соли, которые важны для осуществления функций живых организмов.
Вода
Вода (H2O) представляет собой вещество, которое в физическом и химическом отношении существенно отличается от других растворителей. Жизнь возникла в первичном океане, и в процессе дальнейшего развития природа использовала уникальные свойства воды.
У воды в отличии от других жидкостей необычайно высокие температуры кипения и плавления и высокая удельная теплоемкость. Также отличительными особенностями воды являются большая удельная теплота испарения, плавления и высокое поверхностное натяжение. Вода имеет все эти свойства благодаря тому, что ее молекулы более прочно связаны друг с другом в отличии от молекул других растворителей.
Эти уникальные свойства воды оказывают большое влияние на жизнедеятельность клеток. Например, высокая теплоемкость воды, т.е. способность поглощать тепло при незначительном изменении своей собственной температуры, предохраняет клетки от резких изменений температуры.
Высокую теплоту испарения воды живые организмы используют для предохранения от перегрева. Вспомним, что испарение жидкости животными и растениями — это защитная реакция на повышение температуры.
Благодаря высокой теплопроводности воды обеспечивается равномерное распределение теплоты по всему организму, а благодаря тому, что вода плохо сжимается, клетки обладают упругостью и могут поддерживать свою форму.
Свои уникальные физические и химические свойства вода получила благодаря особенностям структуры своей молекулы, а точнее, благодаря тому, как именно в молекуле воды располагаются электроны в атомах кислорода и водорода.
Два электрона, располагающиеся на внешней электронной орбите атома кислорода в молекуле воды, объединяются с двумя электронами, принадлежащими атомам водорода (у атома водорода на внешней орбите только один электрон). Благодаря этому в молекуле воды образуются две ковалентные связи (между атомом кислорода и двумя атомами водорода).
Электроотрицательность* атома кислорода выше, чем у атомов водорода, благодаря чему, электроны притягиваются к нему сильнее. В результате этого на атоме кислорода появляется частично отрицательный заряд, а на атомах водорода — частично положительный.
Между более отрицательно заряженными атомами кислорода одних молекул воды и более положительно заряженными атомами водорода других молекул воды образуются так называемые водородные связи, и молекулы воды оказываются связанными между собой.
* Электроотрицательность — это способность атома в молекуле смещать к себе общие электронные пары. Относится к фунадментальным свойствам атома и выражается в количественных характеристиках.
5 молекул воды с водородными связями между ними
На рисунке изображены молекулы воды. Ковалентные связи связывают атомы кислорода и водорода внутри каждой молекулы (сплошные линии), а водородные связи образуются между соседними молекулами (пунктирные линии).
Водородные связи примерно в 20 раз более слабые, чем ковалентные. Поэтому они легко образуются и разрываются. Даже при температуре кипения (100°С) взамодействие между молекулами воды остается достаточно сильным. Именно водородные связи обеспечивают структурированность воды и объясняют такие ее свойства, как высокие температуры кипения и плавления, а также высокую теплоемкость.
Другое важное свойство молекулы воды — ее дипольность. В молекуле воды, как отмечалось ранее, атомы кислорода имеют небольшой отрицательный заряд, а атомы водорода — положительный. Т.к. угол между связями H-O-H составляет 104.5°, получается, что отрицательный заряд в молекуле воды сосредотачивается на одной стороне, а положительный — на другой.
Благодаря дипольности молекулы воды имеют способность к ориентации в электрическом поле. Это свойство объясняет, что вода является уникальным растворителем. Если в молекулах веществ присутствуют заряженные группы атомов, они, вступая в электростатическое взаимодействие с молекулами воды, растворяются в ней.
Такие вещества с заряженными или полярными группами, растворяющиеся в воде, называются гидрофильными.
Растворение NaCl в воде.
Способность воды растворять кристалл NaCl зависит от электростатического притяжения между полярными молекулами воды и заряженными ионами натрия и хлора.
К гидрофильным соединениям, которые в большом количестве есть в клетках, относятся соли, некоторые низкомолекулярные органические соединения (органические кислоты, аминокислоты, простые сахара), а также полимеры: некоторые полисахариды, белки, нуклеиновые кислоты.
Однако существует ряд веществ, почти не имеющих заряженных атомов, и, поэтому, не растворяющихся в воде. Такие вещества называются гидрофобными. К ним, например, относятся липиды (жиры).
Гидрофобные вещества не взаимодействуют с водой, но могут взаимодействовать друг с другом. Поэтому они хорошо растворяются в некоторых органических растворителях, как, например, хлороформ.
Липиды, относящиеся к гидрофобным соединениям, формируют двумерные структуры (биологические мембраны), практически непроницаемые для воды.
По сравнению с другими растворителями вода может растворить больше химических веществ, благодаря своей полярности.
Жизнедеятельность клетки невозможна без многочисленных химических реакций, которые осуществляются в ее водной среде, где растворены различные химические вещества. Также вода растворяет и продукты реакций.
Затем в растворенном виде они выводятся из клеток и многоклеточных организмов. За счет перемещения воды в организмах животных и растений осуществляется обмен различными веществами между тканями.
Еще одним важным свойством воды является то, что, как химическое соединение, вода вступает во многие химические реакции, которые протекают в клетке. Такие реакции называют реакциями гидролиза. В свою очередь, молекулы воды сами образуются в результате многих реакций в клетках живых организмов.
Т.к. масса атома водорода мала, а атом кислорода в молекуле воды удерживает его единственный электрон, протон (ядро атома водорода, лишенное электрона) способен отрываться от молекулы воды. В результате этого из молекулы воды образуются гидроксильный ион (ОН—) и протон (Н+).
H2O H+ + OH—
Данный процесс называют диссоциацией воды. Гидроксильные ионы и протоны, которые образуются при диссоциации воды, являются, в свою очередь, участниками многих важных реакций в живых организмах.
Соли
В жизнедеятельности клетки также очень важны соли, растворенные в воде. Главным образом соли представлены катионами калия (К+), натрия (Na+), магния (Mg2+), кальция (Ca2+) и других металлов, а также анионами соляной (Cl—), угольной (НСО3—) и фосфорных кислот (Н2РО4—, НРО42-).
Многие катионы характеризуются неравномерным распределением между клеткой и окружающей ее средой. Например, для цитоплазмы характерна более высокая концентрация К+, чем для окружающей клетку среды, между тем, в той же цитоплазме концентрация Na+ и Са2+ будет ниже, чем снаружи клетки.
В качестве внешней среды по по отношению к клетке может выступать не только природная среда, например, океан, но и жидкости внутри живого организма, такие как кровь или тканевая жидкость, близкие по своему ионному составу к морской воде.
В процессе жизнедеятельности неравномерное распределение катионов между клетками и окружающей их средой постоянно поддерживается, на это затрачивается значительная часть энергии в клетках.
Такая неравномерная концентрация ионов между клетками и окружающей их средой необходима для многих процессов жизнедеятельности, к примеру, для передачи возбуждения по нервным и мышечным клеткам или сокращения мышц. Когда клетка умирает, концентрация катионов внутри нее и снаружи быстро становится одинаковой.
Кислотность цитоплазмы клетки в процессе жизнедеятельности практически нейтральная (т.е. значение концентрации ионов водорода (рН) в цитоплазме находится в диапазоне 6,5-7,5).
Это происходит несмотря на то, что в процессе жизнедеятельности в клетке образуются и щелочи, и кислоты. Важную роль в поддержании нейтральной кислотности играют анионы слабых кислот (НСО3—, НРО42-), содержащиеся в клетке.
Анионы слабых кислот нейтрализуют внутриклеточную среду, связывая протоны кислот и гидроксильные ионы щелочей.
Необходимо отметить, что анионы слабых кислот вступают в химические реакции, происходящие в клетке. Например, для синтеза АТФ, одного из важных соединений для клетки, необходимы анионы фосфорной кислоты. О синтезе АТФ я расскажу более подробно позднее.
Неорганические вещества в живых организмах содержатся не только в растворенном, но и в твердом состоянии. В качестве примера можно привести кости, где преобладает фосфат кальция и в меньшем количестве фосфат магния.
В раковинах моллюсков преобладает карбонат кальция.
Перейти к оглавлению.
Вода: физические, химические свойства, химическая формула, плотность
Вода, или оксид (окись) водорода Н2О – важнейшая среда, в которой проходят все химико-биологические реакции. На 65-70 % организмы животных и человека состоят из воды. Ее содержание в растениях еще выше – 90 %. Вода – это основа жизни.
Строение воды
Вода – неорганическое соединение с формулой Н2О. Она состоит из кислородного атома, который связан с двумя водородными атомами. Угол между атомами Н-О-Н составляет 104,5˚.
Кислород – электроотрицательный элемент, к которому смещены общие электронные пары. На кислороде возникает частично отрицательный заряд, а на водороде – частично положительный. Вода – электрический диполь.
Многие свойства воды обусловлены ее полярностью.
Молекулы воды между собой образовывают водородные связи, которые объясняют высокую плотность и температуру кипения. Чем выше температура реакции, тем меньшее количество связей образуется.
Физические свойства воды
Вода – бесцветная жидкость, у которой отсутствует запах и вкус. Она обладает рядом физических свойств.
- Температура кипения 100˚С (при давлении 101,3 кПа).
- Температура замерзания 0˚С.
- Максимальная плотность воды (характерна при 4˚С) 1 г/см3.
Лед всегда всплывает в водоемах или стаканах с водой. Это связано с тем, что плотность горячей и холодной воды отличается.
Лед обладает меньшей плотностью, чем жидкая вода.
Воде свойственна высокая теплоемкость, поэтому она медленно нагревается и остывает. С помощью теплофизических свойств воды регулируется климат. Водные бассейны регулируют температуру на нашей планете. Вода задерживает до 60 % теплового излучения нашей планеты, не позволяя ей охлаждаться.
Теплопроводность воды небольшая. Вода в водоемах нагревается не с помощью молекулярной теплопроводности, а путем перемешивания с помощью волн и течений. Если вода не перемешивается, то она нагревается частями и образуется термическая слоистость (стратификация).
Физсвойства воды отражаются в агрегатных состояниях:
- Н2О – молекула парообразной воды (гидроль);
- (Н2О)2 – молекула жидкой воды (дигидроль);
- (Н2О)3 – молекула твердой воды (тригидроль).
В химии физические свойства воды отражаются в количестве связей между молекулами. В парах находятся отдельные молекулы, в жидкостях между ними образуются водородные связи. Если вода находится в состоянии льда, то каждая молекула соединена с соседними молекулами с помощью четырех водородных связей.
Растворимость веществ в воде
Растворимость – максимальная масса вещества, которая может раствориться в 100 г растворителя при определенной температуре. Вещества классифицируются на три группы в зависимости от степени растворимости.
- Хорошо растворимые – в 100 мл воды растворяется более 1 г вещества (сахар).
- Малорастворимые – в 100 мл воды растворяется 0,01-1 г вещества (гипс).
- Нерастворимые – в 100 мл воды растворяется менее 0,01 вещества (хлорид серебра (I)).
Большинство твердых веществ при нагревании растворяется быстрее.
Растворимость газов повышается при понижении температуры и повышении давления.
Растворение многих веществ в воде сопровождается образованием оболочки из молекул воды. Данный комплекс называется гидратом. После кристаллизации в составе таких комплексов сохраняется часть молекул воды, образуя кристаллогидрат:
CuSO4 +5 H2O = CuSO4· 5H2O
Растворы
Растворы – гомогенные смеси, которые включают частицы растворенного вещества, растворитель и продукты их реакции. Растворы классифицируют на две группы:
- насыщенные (вещество в растворе больше не растворяется при определенной температуре);
- ненасыщенные (вещество продолжает растворяться при определенной температуре).
Химические свойства воды
Вода вступает во взаимодействие с рядом веществ.
- Со щелочными и щелочно-земельными металлами
- 2 Na + 2 H2O = 2 NaOH + H2↑
- С металлами при нагревании
- Fe + 4 H2O = Fe3O4 + 4 H2↑
- С неметаллами при нагревании
- С оксидами активных металлов
- С оксидами неметаллов
- SO3 + H2O = H2SO4 Вода может разлагаться под действием электрического тока или температуры в 2000˚С.2 Н2О → 2 Н2↑ + О2↑
Вода – важнейший компонент такой реакции как гидролиз. Гидролиз – взаимодействие соли с водой, в результате которого происходит ионный обмен между молекулами.
Na3PO4 + H2O ↔ Na2HPO4 + NaOH
Очистка воды
Вода – самое распространенное вещество на нашей планете. Она наполняет океаны, моря, озера. Пары воды входят в состав воздуха. Природная вода всегда содержит различные примеси. В зависимости от целей использования применяют различные способы очистки воды.
В питьевой воде не должны содержаться примеси и болезнетворные бактерии. Чтобы вода из озер и рек была пригодна для питья, ей дают отстояться в специальных бассейнах. Затем ее фильтруют через слой песка.
Очищенную от нерастворимых веществ воду обрабатывают хлором, озоном или ультрафиолетовыми лучами.
Для очищения воды от растворенных в ней веществ используют перегонку, или дистилляцию. Этим способом получают дистиллированную воду. Ее применяют в лабораториях, аптеках, охладительных системах машин и т. д.
Применение воды
Воду используют в промышленности, сельском хозяйстве и быту. В химическом производстве она является важнейшим сырьем для получения водорода. При получении оснований и кислот применяется способность воды вступать в реакции с некоторыми оксидами.
Также вода часто выступает в роли растворителя.
Развитие промышленности привело к тому, что многие водоемы загрязнены отходами производства.
Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию природных ресурсов.
Вода – важный ресурс для всего живого на планете. Если ее запасы на Земле иссякнут, то растения, животные и человек погибнут. Вода является более ценным природным богатством, чем нефть и газ, железо и уголь и т. д. Это связано с тем, что воду невозможно ничем заменить.
Урок №4 Химический состав тел живой природы. Вода и минеральные соли. – Бионичка
Химический состав клеток.
Все клетки, независимо от уровня организации, сходны по химическому составу. В живых организмах обнаружено 86 химических элементов периодической системы Д.И.Менделеева. Для 25 элементов известны функции, которые они выполняют в клетке. Эти элементы называются биогенными. По количественному содержанию в живом веществе элементы делятся на три категории:
Макроэлементы, элементы, концентрация которых превышает 0,001%. Они составляют основную массу живого вещества клетки (около 99%). Макроэлементы делят на элементы 1 и 2 группы. Элементы 1-ой группы – C, N, H, O (на их долю приходится 98% от всех элементов). Элементы 2-ой группы – K, Na, Ca, Mg, S, P, Cl, Fe (1,9%).
Микроэлементы (Zn, Mn, Cu, Co, Mo, и многие другие), доля которых составляет от 0,001% до 0,000001%. Микроэлементы входят в состав биологически активных веществ – ферментов, витаминов и гормонов.
Ультрамикроэлементы (Hg, Au, U, Ra и др.), концентрация которых не превышает 0,000001%. Роль большинства элементов этой группы до сих пор не выяснена.
Макро- и микроэлементы присутствуют в живой материи в виде разнообразных химических соединений, которые подразделяются на неорганические и органические вещества.
К неорганическим веществам относятся: вода и минеральные вещества. К органическим веществам относятся: белки, жиры, углеводы, нуклеиновые кислоты, АТФ и другие низкомолекулярные органические вещества.
Неорганические вещества клетки. Вода.
Вода – самое распространенное в живых организмах неорганическое соединение. Ее содержание колеблется в широких пределах: в клетках эмали зубов вода составляет по массе около 10%, а в клетках развивающегося зародыша – более 90%.
Без воды жизнь невозможна. Она не только обязательный компонент живых клеток, но и среда обитания организмов. Биологическое значение воды основано на ее химических и физических свойствах. Химические и физические свойства воды необычны. Они объясняются, прежде всего, малыми размерами молекул воды, их полярностью и способностью соединяться друг с другом водородными связями.
В молекуле воды один атом кислорода ковалентно связан с двумя атомами водорода. Молекула полярна: кислородный атом несет частичный отрицательный заряд, а два водородных – частично положительные заряды. Это делает молекулу воды диполем.
Поэтому при взаимодействии молекул воды друг с другом между ними устанавливаются водородные связи. Они слабее ковалентной, но, поскольку каждая молекула воды способна образовывать 4 водородные связи, они существенно влияют на физические свойства воды.
Большая теплоемкость, теплота плавления и теплота парообразования объясняются тем, что большая часть поглощаемого водой тепла расходуется на разрыв водородных связей между ее молекулами. Вода обладает высокой теплопроводностью, благодаря чему в различных участках клетки поддерживается одинаковая температура.
Вода практически не сжимается, прозрачна в видимом участке спектра. Наконец, вода – единственное вещество, плотность которого в жидком состоянии больше, чем в твердом.
Вода – хороший растворитель ионных (полярных) соединений, а также некоторых не ионных, в молекуле которых присутствуют заряженные (полярные) группы. Если энергия притяжения молекул воды к молекулам какого-либо вещества больше, чем энергия притяжения между молекулами вещества, то молекулы гидратируются и вещество растворяется.
По отношению к воде различают гидрофильные вещества – вещества, хорошо растворимые в воде и гидрофобные вещества – вещества, практически нерастворимые в воде. Есть органические молекулы, у которых один участок – гидрофилен, другой – гидрофобен.
Такие молекулы называют амфипатическими, к ним относятся, например, фосфолипиды, образующие основу биологических мембран.
Вода является непосредственным участником многих химических реакций (гиролитическое расщепление белков, углеводов, жиров и др.), необходима как метаболит для реакций фотосинтеза.
Большинство биохимических реакций может идти только в водном растворе; многие вещества поступают в клетку и выводятся из нее в водном растворе. Благодаря большой теплоте испарения воды, происходит охлаждение организма.
- Максимальная плотность воды при +4°С, при понижении температуры вода поднимается вверх, а так как плотность льда меньше плотности воды, то лед образуется на поверхности, поэтому при замерзании водоемов подо льдом остается жизненное пространство для водных организмов.
- Благодаря силам когезии (электростатическому взаимодействию молекул воды, водородным связям) и адгезии(взаимодействию с окружающими ее стенками) вода обладает свойством подниматься по капиллярам – один из факторов, обеспечивающих движение воды в сосудах растений.
- Несжимаемость воды определяет напряженное состояние клеточных стенок (тургор), а также выполняет опорную функцию (гидростатический скелет, например, у круглых червей).
- Итак, значение воды для организма заключается в следующем:
- Является средой обитания для многих организмов;
- Является основой внутренней и внутриклеточной среды;
- Обеспечивает транспорт веществ;
- Обеспечивает поддержание пространственной структуры растворенных в ней молекул (гидратирует полярные молекулы, окружает неполярные молекулы, способствуя их слипанию);
- Служит растворителем и средой для диффузии;
- Участвует в реакциях фотосинтеза и гидролиза;
- При испарении участвует в терморегуляции организма;
- Обеспечивает равномерное распределение тепла в организме;
- Максимальная плотность воды при +4°С, поэтому лед образуется на поверхности воды.
Минеральные вещества.
Минеральные вещества клетки в основном представлены солями, которые диссоциируют на анионы и катионы, некоторые используются в неионизированной форме (Fe, Mg, Cu, Co, Ni и др.)
Для процессов жизнедеятельности клетки наиболее важны катионы Na+, Ca2+, Mg2+, анионы HPO42-, Cl-, HCO3-. Концентрации ионов в клетке и среде ее обитания, как правило, различны.
В нервных и мышечных клетках концентрация К+внутри клетки в 30-40 раз больше, чем вне клетки; концентрация Na+ вне клетки в 10-12 раз больше, нежели в клетке. Ионов Сl- вне клетки в 30—50 раз больше, чем внутри клетки.
Существует ряд механизмов, позволяющих клетке поддерживать определенное соотношение ионов в протопласте и внешней среде.
Табл. 1. Важнейшие химические элементы
| Химический элемент | Вещества, в которых химический элемент содержится | Процессы, в которых химический элемент участвует |
| Углерод, водород, кислород, азот | Белки, нуклеиновые кислоты, липиды, углеводы и др. органические вещества | Синтез органических веществ и весь комплекс функций, осуществляемых этими органическими веществами |
| Калий, натрий | Na+ и K+ | Обеспечивают функции мембран, в частности, поддерживают электрический потенциал клеточной мембраны, работу Na+/Ka+-насоса, проведение нервных импульсов, анионный, катионный и осмотический балансы |
| Кальций |
|
Участвует в процессе свертывания крови, сокращения мышц, входит в состав костной ткани, зубной эмали, раковин моллюсковФормирование срединной пластинки и клеточной стенки у растений |
| Магний | Хлорофилл | Фотосинтез |
| Сера | Белки | Формирование пространственной структуры белка за счет образования дисульфидных мостиков |
| Фосфор | Нуклеиновые кислоты, АТФ | Синтез нуклеиновых кислот, фосфорилирование белков (их активирование) |
| Хлор | Cl-HCl | Поддерживает электрический потенциал клеточной мембраны, работу Na+/Ka+-насоса, проведение нервных импульсов, анионный, катионный и осмотический балансыАктивизирует пищеварительные ферменты желудочного сока |
| Железо | ГемоглобинЦитохромы | Транспорт кислородаПеренос электронов при фотосинтезе и дыхании |
| Марганец | Декарбоксилазы, дегидрогеназы | Окисление жирных кислот, участие в процессах дыхания и фотосинтеза |
| Медь | ГемоцианинТирозиназа | Транспорт кислорода у некоторых беспозвоночныхОбразование меланина |
| Кобальт | Витамин В12 | Формирование эритроцитов |
| Цинк | Входит в состав более 100 ферментов: Алькогольдегидрогеназа, карбоангидраза | Анаэробное дыхание у растенийТранспорт СО2 у позвоночных |
| Фтор | Фторид кальция | Костная ткань, зубная эмаль |
| Иод | Тироксин | Регуляция основного обмена |
| Молибден | Нитрогеназа | Фиксация азота |
Различные ионы принимают участие во многих процессах жизнедеятельности клетки: катионы К+, Na+, Ca2+ обеспечивают раздражимость живых организмов; катионы Mg2+, Mn2+, Zn2+, Ca2+ и др. необходимы для нормального функционирования многих ферментов; образование углеводов в процессе фотосинтеза невозможно без Mg2+ (составная часть хлорофилла).
От концентрации солей внутри клетки зависят ее буферные свойства. Буферностью называют способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне (рН около 7,4). Внутри клетки буферность обеспечивается главным образом анионами H2PO4- и НРО42-. Во внеклеточной жидкости и в крови роль буфера играют Н2СО3 и НСО3-.
- Фосфатная буферная система:
- Низкий pH Высокий pH
- НРО42- + Н+ H2PO4-
- Гидрофосфат – ион Дигидрофосфат – ион
- Бикарбонатная буферная система:
- Низкий pH Высокий pH
- НСО3- + Н+ H2СO3
- Гидрокарбонат – ион Угольная кислота
Некоторые неорганические вещества содержатся в клетке не только в растворенном, но и в твердом состоянии. Например, Са и Р содержатся в костной ткани, в раковинах моллюсков в виде двойных углекислых и фосфорнокислых солей.
Источник: ГИА по биологии 31.05.2013. Основная волна. Сибирь. Вариант 1320
Из предложенного списка химических элементов выберите органогены. Выберите два верных ответа из пяти и запишите цифры, под которыми они указаны.
- 1) кислород
- 2) азот
- 3) магний
- 4) хлор
- 5) йод
Пояснение.
Макроэлементы — химические элементы или их соединения, используемые организмами в сравнительно больших количествах: кислород, водород, углерод, азот, железо, фосфор, калий, кальций, сера, магний, натрий, хлор и др. При этом кислород, водород, углерод и азот выделяют в особую группу — органогены.
Ответ: 12.
Источник: ГИА по биологии 31.05.2013. Основная волна. Сибирь. Вариант 1320
Из предложенного списка химических элементов выберите макроэлементы. Выберите два верных ответа из пяти и запишите цифры, под которыми они указаны.
- 1) цинк
- 2) селен
- 3) магний
- 4) хлор
- 5) йод
Пояснение.
Макроэлементы — химические элементы или их соединения, используемые организмами в сравнительно больших количествах: кислород, водород, углерод, азот, железо, фосфор, калий, кальций, сера, магний, натрий, хлор. При этом кислород, водород, углерод и азот выделяют в особую группу — органогены.
Ответ: 34.
Задание 4 № 20643
Все приведённые ниже химические элементы, кроме двух, являются органогенами. Определите два признака, «выпадающих» из общего списка, и запишите в ответ цифры, под которыми они указаны.
- 1) водород
- 2) азот
- 3) магний
- 4) хлор
- 5) кислород
- Задание 4 № 20644
Все приведённые ниже химические элементы, кроме двух, являются макроэлементами. Определите два признака, «выпадающих» из общего списка, и запишите в ответ цифры, под которыми они указаны.
- 1) цинк
- 2) селен
- 3) магний
- 4) хлор
- 5) фосфор
предыдущая следующая


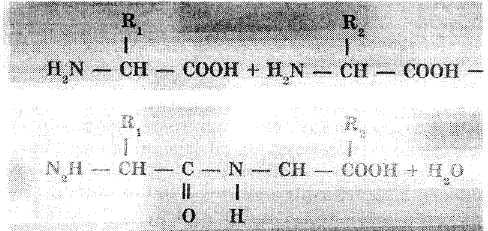
 Буферноетыо называют способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне. Буферные растворы характеризуются тем, что внесение в них или образование в процессе обмена веществ небольших количеств кислоты или щелочи не оказывает влияния на значения рН вследствие образования соединений с карбонатами, фосфатами или органическими молекулами. Внутри клетки буферность обеспечивается главным образом анионами Н2РО4″. Во внеклеточной жидкости и в крови роль буфера играют Н2СО3″ и НСОз “. Анионы слабых кислот и слабые щелочи связывают ионы водорода (НГ) и гидроксил-ионы (ОН”), благодаря чему реакция внутри
Буферноетыо называют способность клетки поддерживать слабощелочную реакцию своего содержимого на постоянном уровне. Буферные растворы характеризуются тем, что внесение в них или образование в процессе обмена веществ небольших количеств кислоты или щелочи не оказывает влияния на значения рН вследствие образования соединений с карбонатами, фосфатами или органическими молекулами. Внутри клетки буферность обеспечивается главным образом анионами Н2РО4″. Во внеклеточной жидкости и в крови роль буфера играют Н2СО3″ и НСОз “. Анионы слабых кислот и слабые щелочи связывают ионы водорода (НГ) и гидроксил-ионы (ОН”), благодаря чему реакция внутри