Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми.
Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными.
Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное.
В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной.
В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов.
На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020.
Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций.
В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка.
Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами.
Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость.
На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.
Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия.
В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы.
У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
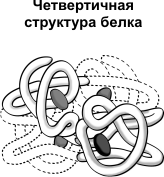
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям.
Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин.
Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Свойства белков
- Купить проверочные работы по биологии
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные.
Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций.
Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией.
Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью.
Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов.
Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е.
в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром.
Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента.
При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента.
Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
- оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому — дегидрогеназа),
- трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому — трансаминаза),
- гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта — амилаза, липаза),
- лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S — декарбоксилаза),
- изомеразы (внутримолекулярная перестройка — изомераза),
- лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S — синтетаза).
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
- Перейти к лекции №2 «Строение и функции углеводов и липидов»
- Перейти к лекции №4 «Строение и функции нуклеиновых кислот АТФ»
- Смотреть оглавление (лекции №1-25)
Белки
Белки – наиболее важные органические соединения клетки. Их содержание колеблется от 50% до 80% в разных клетках организма.
Строение белков
В состав белков, кроме 4 основных химических элементов (углерод, кислорода, водород, азот), могут входит фосфор, сера, железо. Белки – сложные высокомолекулярные соединения, которые составлены из аминокислотных последовательностей.
Аминокислоты состоят из двух частей: аминогруппы -NH2 и карбоксильной группы -COOH.
Первая несет в себе основные свойства, а вторая – кислотные, что обуславливает активности и амфотерность этих соединений (Амфотерность – проявление кислотных или основных свойств в зависимости от реакции). Аминокислоты отличаются радикалами.
Строение аминокислоты
Аминокислоты ассоциируются с генетическим кодом, так как последовательности нуклеотидов кодируют триплеты нуклеотидов. Такие задачи изучаются в школе и встречаются в ЕГЭ. Всем, кто сталкивался с генетикой, хорошо знакома таблица аминокислот:
Таблица аминокислот
В один белок может входить много аминокислот. Они соединяются в цепь посредством образования пептидных связей: азот одной аминокислоты связывается с углеродом другой аминокислоты:
Строение белка. Зеленым цветом обозначена карбоксильная группа аминокислоты, голубым цветом — аминогруппа аминокислоты
В состав белка может входить даже несколько аминокислотных цепей.
Всего аминокислот насчитывается около 170, однако основное разнообразие задают 20 аминокислот, что связано с тем, что одна аминокислота может кодироваться различными последовательностями кодонов, или другими словами, аминокислота может кодироваться разными триплетами нуклеотидов. Это одно из свойств генетического кода (свойство избыточности).
Некоторые аминокислоты животный организм синтезирует самостоятельно, но, как можно догадаться, не все. Такие аминокислоты называются незаменимыми аминокислотами, их следует употреблять с пищей.
Например, лейцин используется не просто как биологическая добавка, что достаточно распространено среди фармакологических компаний, но и применяется при лечении заболеваний печени, а также анемии, она же малокровие.
Классификация белков
Протеины – белки, в состав которых входят только белковые молекулы.
Протеиды – белки, в состав которых, кроме белковых молекул, входят небелковые молекулы.
- Гликопротеиды (белок + углевод)
- Липопротеиды (белок + липид)
- Нуклеопротеиды (белок + нуклеиновые кислоты)
Для того чтобы не путаться в понятиях, нужно вспомнить, что принимают спортсмены для того, чтобы скорее нарастить мышечную массу, то есть протеиновые коктейли, батончики и т.д. Именно протеиновые, это слово на слуху, пусть теперь оно ассоциируется с этой классификацией.
Уровни организации белковой молекулы
Структура белка именуется просто по счету, в зависимости от сложности укладки.
Первичная структура белка представляет собой прямую цепь из аминокислот. Она является главной и определяющей свойства, форму и функции белка.
Вторичная структура белка – уже две цепи. Однако эти цепи не идут параллельно друг другу. Они скручены в спираль и связаны водородными связями, которые их удерживают за счет того, что их много. ДНК была обнаружена именно в форме двойной спирали. В этом виде она наиболее известна.
Третичная структура белка – глобула. Глобула означает шар, что и является описанием структуры белка. В этом случае прочность обусловлена тремя видами связей: водородными, ионными и дисульфидными.
Четвертичная структура белка – это как бы глобула из глобул. Она встречается не у всех белков. Белок крови гемоглобин состоит из 4х субъединиц четвертичной структуры.
Первичная структура белка — цепь Вторичная структура белка — спираль Четвертичная структура белка — объединение глобул
Денатурация – утрата белковой молекулой своей природной структуры. Это обратимый процесс, похожий на сохранение в игре. Если белок денатурировал, но его природная структура не нарушена, то он восстановится.
Причин разрушения белка может быть много: высокая температура, химические повреждения, радиация, обезвоживание и т.д. Так что когда мы варим яйца или мясо, то происходит денатурация белка. Как мы видим, к исходному состояния он уже не возвращается (не ренатурирует).
Денатурацию и ренатурацию просто запомнить по похожим словам: денатурация – деградация – разрушение; ренатурация – регенерация – восстановление.
Денатурация и ренатурация
Функции белков
1.Структурная функция
Белки входят в состав всего в клетке: мембраны и органоиды. Кроме того, есть белки, которые очень важно знать:
- Коллаген – входит в состав соединительной ткани. Коллаген можно запомнить по кремам, которые обещают продлить молодость и расправить морщины.
- Кератин – известен всем, кто когда-либо смотрел рекламу шампуня для волос. Кератин входит в структуру волос и прочих производных нашего и животного тела: шерсть, перья, ногти, когти, копыта, рога.
Органические вещества клетки: белки
Белки – это биологические гетерополимеры; синтезируются в живых организмах и выполняют в них важнейшие функции. В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.
Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу NH2 и карбоксильную группу СООН и изменяемую часть – радикал (по которому и различаются аминокислоты).
Аминокислоты обладают свойствами и кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут (отсюда – заменимые и незаменимые аминокислоты). Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных.
Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Незаменимых аминокислот восемь: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Если они не поступают в организм, происходит значительное нарушение его функций.
Запомнить незаменимые аминокислоты можно так:
- Таблица аминокислот
- Структура белковой молекулы – это ее аминокислотный состав, последовательность мономеров (аминокислот) и степень скрученности молекулы.
1. Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
2. Сначала длинная молекула белка сворачивается и приобретает вид спирали. При этом образуется вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие витки спирали в свернутом положении.
3. Далее молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями, обеспечивающими сцепку между отдельными участками спирали.
4. Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными. Однако прочность этих связей невелика и структура белка может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
Нарушение четвертичной, третичной и вторичной структур ↔обратимо↔.
Разрушение первичной структуры необратимо.
Белки имеют видовую специфичность: каждый вид организмов обладает белками, не встречающимися у других видов.
Урок 3. органические вещества: белки и нуклеиновые кислоты, и их значение. атф – Биология – 10 класс – Российская электронная школа
Биология, 10 класс
Урок 3. «Органические вещества: белки и нуклеиновые кислоты и их значение. АТФ»
- Перечень вопросов, рассматриваемых в теме;
- Урок позволит выявить особенности строения макромолекул, определяющие многообразие белковых молекул, а также обеспечивающие возможность хранения и реализации генетической информации нуклеиновыми кислотами.
- Глоссарий по теме (перечень терминов и понятий, введенных на данном уроке);
- Белки; аминокислоты; пептидная связь; полипептид; незаменимые аминокислоты; структура белковой молекулы; глобулярные и фибриллярные белки; денатурация белка; ферменты; гормоны; антитела; рецепторы; нуклеиновые кислоты; нуклеотид; ДНК; РНК; АТФ; копмлементарность.
- Белки – азотсодержащие высокомолекулярные органические соединения, нерегулярные полимеры, мономерами которых являются аминокислоты.
- Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильная группа (- СООН) и аминогруппа (- NН2).
- Пептидная связь – это прочная ковалентная связь, возникающая при образовании белков (пептидов) в результате взаимодействия аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты.
- Полипептид – соединение, состоящее из более 20 аминокислотных остатков.
Незаменимые аминокислоты – необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме. Незаменимыми для взрослого здорового человека являются 8 аминокислот.
Структура белковой молекулы – сложная пространственная структура, обладающая первичным, вторичным, третичным и четвертичным уровнями организации. Особенности структурной организации белковой молекулы определяются первичным уровнем ее организации.
Для того чтобы осуществлять свои биологические функции, белки сворачиваются в одну или несколько особых пространственных конфигураций, обусловленных рядом нековалентных взаимодействий, таких, как водородные связи, ионные связи, гидрофобные взаимодействия и др.
Глобулярные белки – белки, в молекулах которых полипептидные цепи плотно свёрнуты в глобулы (компактные шарообразные третичные структуры). Глобулярную структуру имеют ферменты, иммуноглобулины, некоторые гормоны.
Фибриллярные белки – белки, в молекулах которых расположенные параллельно друг другу вытянутые полипептидные цепи образуют длинные нити или слои (коллаген, кератин, фиброин).
Денатурация – это утрата белковой молекулой своей структурной организации. Она может быть вызвана изменением температуры, обезвоживанием, изменением кислотности раствора и другими воздействиями. В результате денатурации белок теряет способность выполнять свою функцию.
Ферменты – органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям.
Гормоны – биологически активные вещества органической природы, вырабатывающиеся в специализированных клетках желёз внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен веществ и физиологические функции. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в различных органах и системах. По химической природе могут быть белками, производными аминокислот, липидами.
Антитела (иммуноглобулины) – белковые соединения плазмы крови, образующиеся в ответ на введение в организм человека или теплокровных животных бактерий, вирусов, белковых токсинов и других антигенов. Связываясь активными участками (центрами) с бактериями или вирусами, антитела препятствуют их размножению или нейтрализуют выделяемые ими токсические вещества.
Клеточный рецептор – молекула (обычно белок или гликопротеид) на поверхности клетки, клеточных органелл или растворенная в цитоплазме.
Специфично реагирует изменением своей пространственной конфигурации на присоединение к ней молекулы определённого химического вещества, передающего внешний регуляторный сигнал и, в свою очередь, передает этот сигнал внутрь клетки или клеточной органеллы.
Нуклеиновые кислоты – природные биополимеры, образованные остатками нуклеотидов, обеспечивающие хранение, передачу и реализацию наследственной (генетической) информации в живых организмах.
Нуклеотид – низкомолекулярные вещества, которые выполняют функции биорегуляторов (НАД, НАДФ, АТФ и др.) либо входят в состав полимерных молекул ДНК и РНК. В состав нуклеотида входит азотистое основание, углевод пентоза и остаток фосфорной кислоты.
Дезоксирибонуклеиновая кислота (ДНК) – макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Молекула ДНК хранит биологическую информацию в виде генетического кода, состоящего из последовательности нуклеотидов. ДНК содержит информацию о структуре различных видов РНК и белков.
Рибонуклеиновые кислоты (РНК) – макромолекулы, биологическая функция которых связана с реализацией наследственной информации в клетке.
Аденозинтрифосфорная кислота (аденозинтрифосфат, АТФ) – нуклеотид с тремя остатками фосфорной кислоты, имеющий большое значение в обмене энергии и веществ в организмах. АТФ — универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Комплементарность – способность нуклеотидов к избирательному соединению друг с другом. Комплементарность обеспечивается взаимодополнением пространственных конфигураций молекул азотистых оснований, а также количеством водородных связей, возникающих между азотистыми основаниями.
Основная и дополнительная литература по теме урока (точные библиографические данные с указанием страниц);
Обязательная литература:
1. Беляев Д.К., Дымшиц Г.М. Биология. 10 класс: учебник для общеобразовательных организаций: базовый уровень. – М.: Просвещение, 2014. – стр. 20-37;
Дополнительные источники:
2. Тейлор Д., Грин Н., Стаут У. Биология: в 3т. Том 1. – М.: Лаборатория знаний, 2016. – стр. 124-167
3. Кириленко А.А. Биология. ЕГЭ. Раздел «Молекулярная биология»: учебное пособие. – Ростов на Дону: Легион, 2017.
6. Открытые электронные ресурсы по теме урока (при наличии);
1. Молекулярная биология (белки, нуклеиновые кислоты) / Сайт Биология и медицина http://medbiol.ru/medbiol/biology_sk/000034fe.htm
2. Химия белков. Сайт Химик http://www.xumuk.ru/biologhim/001.html
Теоретический материал для самостоятельного изучения;
Белки — наиболее специфичны и важны для организма. Они относятся к непериодическим полимерам. В отличие от других полимеров их молекулы состоят из сходных, но нетождественных мономеров — 20 различных аминокислот.
Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде
Молекула аминокислоты состоит из специфической части (радикала R) и части, одинаковой для всех аминокислот, включающей аминогруппу (— NH2) с основными свойствами, и карбоксильную группу (СООН) с кислотными свойствами.
Наличие в одной молекуле кислотной и основной групп обусловливает их высокую реактивность. Через эти группы происходит соединение аминокислот при образовании полимера — белка.
При этом из аминогруппы одной аминокислоты и карбоксила другой выделяется молекула воды, а освободившиеся электроны соединяются, образуя пептидную связь. Поэтому белки называют полипептидами.
Молекула белка представляет собой цепь из нескольких десятков или сотен аминокислот.
Молекулы белков имеют огромные размеры, поэтому их называют макромолекулами. Белки, как и аминокислоты, обладают высокой реактивностью и способны реагировать с кислотами и щелочами. Они различаются по составу, количеству и последовательности расположения аминокислот (число таких сочетаний из 20 аминокислот практически бесконечно). Этим объясняется многообразие белков.
В строении молекул белков различают четыре уровня организации (59)
- Первичная структура — полипептидная цепь из аминокислот, связанных в определенной последовательности ковалентными (прочными) пептидными связями.
- Вторичная структура — полипептидная цепь, закрученная в тугую спираль. В ней между пептидными связями соседних витков (и другими атомами) возникают малопрочные водородные связи. В комплексе они обеспечивают довольно прочную структуру.
- Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию — глобулу. Она удерживается малопрочными гидрофобными связями или силами сцепления между неполярными радикалами, которые встречаются у многих аминокислот. Благодаря их многочисленности они обеспечивают достаточную устойчивость белковой макромолекулы и ее подвижность. Третичная структура белков поддерживается также за счет ковалентных S — S (эс — эс) связей, возникающих между удаленными друг от друга радикалами серосодержащей аминокислоты — цистеина.
- Четвертичная структура типична не для всех белков. Она возникает при соединении нескольких белковых макромолекул, образующих комплексы. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул этого белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам. Однако строение белковых молекул зависит от свойств окружающей среды.
Нарушение природной структуры белка называют денатурацией. Она может возникать под воздействием высокой температуры, химических веществ, лучистой энергии и других факторов.
При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде первичной структуры — полипептидной цепи, Этот процесс частично обратим, и денатурированный белок способен восстанавливать свою структуру.
Роль белка в жизни клетки огромна.
Белки — это строительный материал организма. Они участвуют в построении оболочки, органоидов и мембран клетки и отдельных тканей (волос, сосудов и др.). Многие белки выполняют в клетке роль катализаторов — ферментов, ускоряющих клеточные реакции в десятки, сотни миллионов раз. Известно около тысячи ферментов. В их состав, кроме белка, входят металлы Mg, Fe, Мn, витамины и т. д.
Каждая реакция катализируется своим особым ферментом. При этом действует не весь фермент, а определенный участок — активный центр. Он подходит к субстрату, как ключ к замку. Действуют ферменты при определенной температуре и рН среды. Особые сократительные белки обеспечивают двигательные функции клеток (движение жгутиковых, инфузорий, сокращение мышц и т. д.).
Отдельные белки (гемоглобин крови) выполняют транспортную функцию, доставляя кислород ко всем органам и тканям тела. Специфические белки — антитела — выполняют защитную функцию, обезвреживая чужеродные вещества. Некоторые белки выполняют энергетическую функцию. Распадаясь до аминокислот, а затем до еще более простых веществ, 1 г белка освобождает 17,6 кДж энергии.
Нуклеиновые кислоты (от лат. «нуклеус» — ядро) впервые обнаружены в ядре. Они бывают двух типов — дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (РНК). Биологическая роль их велика, они определяют синтез белков и передачу наследственной информации от одного поколения к другому.
Молекула ДНК имеет сложное строение. Она состоит из двух спирально закрученных цепей.
Ширина двойной спирали 2 нм1, длина несколько десятков и даже сотен микромикрон (в сотни или тысячи раз больше самой крупной белковой молекулы).
ДНК — полимер, мономерами которой являются нуклеотиды — соединения, состоящие из молекулы фосфорной кислоты, углевода — дезоксирибозы и азотистого основания. Их общая формула имеет следующий вид:
Фосфорная кислота и углевод одинаковы у всех нуклеотидов, а азотистые основания бывают четырех типов: аденин, гуанин, цитозин и тимин. Они и определяют название соответствующих нуклеотидов:
- адениловый (А),
- гуаниловый (Г),
- цитозиловый (Ц),
- тимидиловый (Т).
Каждая цепь ДНК представляет полинуклеотид, состоящий из нескольких десятков тысяч нуклеотидов. В ней соседние нуклеотиды соединены прочной ковалентной связью между фосфорной кислотой и дезоксирибозой.
При огромных размерах молекул ДНК сочетание в них из четырех нуклеотидов может быть бесконечно большим.
При образовании двойной спирали ДНК азотистые основания одной цепи располагаются в строго определенном порядке против азотистых оснований другой. При этом против А всегда оказывается Т, а против Г — только Ц.
Это объясняется тем, что А и Т, а также Г и Ц строго соответствуют друг другу, как две половинки разбитого стекла, и являются дополнительными или комплементарными (от греч. «комплемент» — дополнение) друг другу.
Если известна последовательность расположения нуклеотидов в одной цепи ДНК, то по принципу комплементарности можно установить нуклеотиды другой цепи (см. приложение, задача 1). Соединяются комплементарные нуклеотиды при помощи водородных связей.
Между А и Т возникают две связи, между Г и Ц — три.
Удвоение молекулы ДНК — ее уникальная особенность, обеспечивающая передачу наследственной информации от материнской клетки дочерним. Процесс удвоения ДНК называется редупликацией ДНК. Он осуществляется следующим образом.
Незадолго перед делением клетки молекула ДНК раскручивается и ее двойная цепочка под действием фермента с одного конца расщепляется на две самостоятельные цепи. На каждой половине из свободных нуклеотидов клетки, по принципу комплементарности, выстраивается вторая цепь.
В результате вместо одной молекулы ДНК возникают две совершенно одинаковые молекулы.
РНК — полимер, по структуре сходный с одной цепочкой ДНК, но значительно меньших размеров. Мономерами РНК являются нуклеотиды, состоящие из фосфорной кислоты, углевода (рибозы) и азотистого основания. Три азотистых основания РНК — аденин, гуанин и цитозин — соответствуют таковым ДНК, а четвертое — иное. Вместо тимина в РНК присутствует урацил.
Образование полимера РНК происходит через ковалентные связи между рибозой и фосфорной кислотой соседних нуклеотидов.
Известны три вида РНК: информационная РНК (и-РНК) передает информацию о структуре белка с молекулы ДНК; транспортная РНК (т-РНК) транспортирует аминокислоты к месту синтеза белка; рибосомная РНК (р-РНК) содержится в рибосомах, участвует в синтезе белка.
АТФ — аденозинтрифосфорная кислота — важное органическое соединение. По структуре это нуклеотид. В его состав входит азотистое основание аденин, углевод — рибоза и три молекулы фосфорной кислоты. АТФ — неустойчивая структура, под влиянием фермента разрывается связь между «Р» и «О», отщепляется молекула фосфорной кислоты и АТФ переходит в АДФ (аденозин-дифосфорную кислоту).
Эта реакция сопровождается выделением 40 кДж энергии, поэтому фосфорнокислородную связь называют макроэнергетической связью и обозначают знаком [бесконечность]. В АТФ имеются две такие связи. Если отщепляются две молекулы фосфорной кислоты, то АТФ переходит в АМФ (аденозинмонофосфорную кислоту).
- АТФ играет центральную роль в превращении энергии в клетке.
- Примеры и разбор решения заданий тренировочного модуля (не менее 2 заданий).
- Задание 1.
Все перечисленные ниже признаки, кроме двух, можно использовать для описания яичного белка альбумина. Определите два признака, «выпадающих» из общего списка.
|
|
Задание 2.
| 11. мозаика |
| Соберите из элементов изображение молекулы вещества, являющегося универсальным источником энергии для многих биохимических процессов, протекающих в живых системах.Изображение необходимо разрезать на тайлы таким образом, чтобы была возможность выбора варианта соединения между разными компонентами молекулы. |
| Тип вариантов ответов: (Текстовые, Графические, Комбинированные)Правильные ответы:Подсказка: универсальным источником энергии для многих биохимических процессов, протекающих в живых системах, является АТФ (аденозинтрифосфат). АТФ – адениловый нуклеотид, к которому присоединены ещё два остатка фосфорной кислоты. |

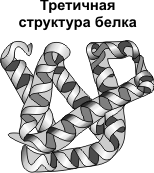

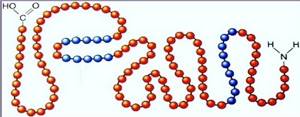 Первичная структура белка — цепь
Первичная структура белка — цепь 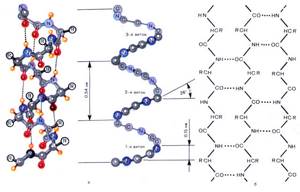 Вторичная структура белка — спираль
Вторичная структура белка — спираль 
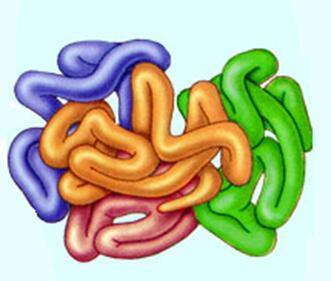 Четвертичная структура белка — объединение глобул
Четвертичная структура белка — объединение глобул 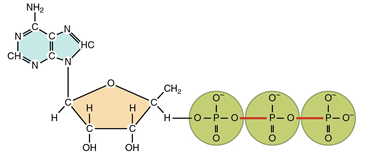 Изображение необходимо разрезать на тайлы таким образом, чтобы была возможность выбора варианта соединения между разными компонентами молекулы.
Изображение необходимо разрезать на тайлы таким образом, чтобы была возможность выбора варианта соединения между разными компонентами молекулы.