— основа белковой жизни на Земле
А вы знаете, что многие ученые называют жизнь на земле «белковой»? Основу белка составляют аминокислоты. А как они появились на Земле?
Белки — это макромолекулы, имеющие большую молекулярную ( до 1,5 млн у.е.) массу. Все белки являются полимерами нерегулярного строения, состоящими из отдельных мономеров — аминокислот, определяющихся генетическим кодом.
Есть такая гипотеза, что в самом начале на Земле не было всех тех органических соединений, которые мы наблюдаем теперь. И в то далекое-предалекое время наша планета постоянно подвергалась бомбардировке метеоритами и кометами. И эти самые метеориты содержали в себе органические соединения, в том числе и аминокислоты. Получается, что жизнь на Землю принесли извне…
У любой теории есть много как сторонников, так и противников. В научном мире жаркие споры по этой теме до сих пор не угасают, наша задача — разобраться что такое аминокислоты и белки какую роль они играют в нашем мире.
Аминокислота — вещество, имеющее двойственную природу:
Из-за наличия аминогруппы и карбоксильной группы аминокислоты амфотерны — проявляют и основные и кислотные свойства и могут соединяться между собой. Такая связь называется пептидной.
Белков на Земле огромное количество. Это обязательная часть химического состава клетки. Как получилось, что природа имеет столько вариантов?
- Аминокислот в белке много. Вплоть до нескольких тысяч!
- Аминокислоты в белке могут находиться в разной последовательности. Именно разные сочетания аминокислот в белковой цепи дает такую вариативность.
В природе известно 20 видов аминокислот.
Откуда они берутся в природе? Обычно они получаются при гидролизе белков и затем, в ходе обмена веществ, опять образуют белки.
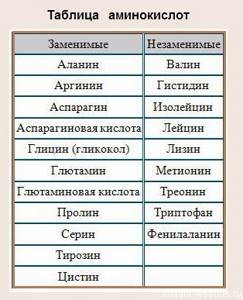
Аминокислоты принято делить на заменимые и незаменимые
- >/center>
- Заменимые аминокислоты наш организм может синтезировать сам, но при этом обеспечивается только минимум потребностей организма.
- Незаменимые аминокислоты — те, которые организм потребляет извне — с белковой пищей или образуются из других аминокислот.
Интересно то, что растения могут синтезировать ВСЕ аминокислоты! Что бы мы без них делали? И кислород они нам для дыхания поставляют, и аминокислотами у них запастись можно… одним словом, Продуценты!
Для формата ЕГЭ не нужно знать наизусть все 20 аминокислот и их формулы, но надо понимать их строение и функции в организме, ведь аминокислоты — «кирпичики» белков, а жизнь у нас именно белковая! ????
они же полипептиды, они же протеины
Ф.Энгельс биологом не был, но дал такое определение жизни:
Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка
- Конечно, это определение не научное и не затрагивает очень многие признаки живых систем, но определяет один самый важный момент —
- жизнь на земле белковая
- Строение и функции белков
Белки — полимеры, мономерами которых являются аминокислоты. В составе белков всего 20 аминокислот, а вот комбинаций этих аминокислот может быть очень много! За счет этого достигается разнообразие. Поэтому белков в природе огромное количество!
- Белковый состав так и записывается — последовательностью аминокислот, которые обозначаются тремя буквами:
- То, что показано на рисунке — последовательность аминокислот — это целая длинная большая молекула (то, что приведено здесь — это очень маленький белок, обычно такие молекулы на порядок длиннее).
- В теме про аминокислоты мы уже рассмотрели механизм образования такого полимера — полипептида.
- Белки делят на:
- простые — состоят только из аминокислот;
- сложные — кроме аминокислот содержат вещества небелковой природы.
- Первичная структура (конформация) белка
- — это именно эта последовательность — то, какие аминокислоты и в какой последовательности они соединены ковалентными связями.
- Вторичная структура белка
- Это спираль, которая образуется уже за счет межмолекулярных — водородных связей.
- Третичная структура белка
- Эта структура образована свернутыми спиралями — такое образование называется глобула.
- Четвертичная структура белка
это совместное объединение нескольких схожих по строению третичных белковых структур (глобул или субъединиц) в единую молекулу с приобретением ею природных свойств.
Сами глобулы в этой структуре называют протомерами, а само четвертичное образование — мультимером.
Белки довольно легко подвергаются разрушению. Сначала «ломается» четвертичная, потом третичная, потом уже вторичная структура. Разрушить первичную структуру сложнее. Это уже, скорее, химическое взаимодействие.
Разрушение структур белка называется денатурацией. Свойства белка при этом теряются.
Самые известные денатуранты -температура (нагревание), спирт, кислоты и щелочи.
Простой и повседневный пример денатурации — яичница! ????
Ренатурация — обратный процесс — восстановление разрушенной структуры белка.
Функции белков
- структурная — белок является обязательным компонентом любой мембраны, любого хряща…
- почти все ферменты имеют белковую природу. Ферменты=биокатализаторы. На каждую реакцию есть свой фермент.
- Гормоны имеют белковую природу.
- Транспорт — белки переносят вещества через мембрану клетки, гемоглобин — кислород в крови…
- Функций у белков очень много… то, что перечислено выше — только самые основные.
Каждый вид растений и животных имеет особый, только ему присущий набор белков, т. е. белки являются основой видовой специфичности.
- у разных видов есть одинаковые белки, выполняющие определенные функции (например, у собаки и человека за регуляцию сахара в крови отвечает гормон инсулин)
- у представителей одного вида белки могут отличаться по строению (например, белки групп крови)
Белки — основа жизни на Земле, и найти какие-либо процессы, проходящие в живом организме без их участия, практически невозможно…
Редко, но все же встречаются в вопросах ЕГЭ такие термины:
- дистальные белки — белки мембраны клетки
Обсуждение: “Аминокислоты и белки”
(Правила комментирования)
Урок 12. аминокислоты. белки – Химия – 10 класс – Российская электронная школа
Химия, 10 класс
Урок № 12. Аминокислоты. Белки
- Перечень вопросов, рассматриваемых в теме: урок посвящён аминокислотам, их строению, номенклатуре, знакомству с пептидной группой и пептидной связью, химическими свойствами аминокислот, пептидам и полипептидам, знакомству с глицином как представителем аминокислот, биологической роли аминокислот, белкам, их структуре, химическим свойствам.
- Глоссарий
- Аминокислота – это азотсодержащее органическое соединение, в составе которой есть как аминогруппа, так и карбоксильная группа.
Белки – органические полимеры, в состав которых входят остатки аминокислот, соединённые пептидной связью. Количество аминокислотных остатков в белках обычно более 50.
Биуретовая реакция – качественная цветная реакция на пептидные связи. При добавлении к белку раствора щёлочи и сульфата меди (II) раствор приобретает красно-фиолетовую окраску.
Гидролиз белка – распад белка на отдельные аминокислоты в водном растворе кислот или щелочей.
Денатурация белка – разрушение вторичной, третичной и четвертичной структуры белка при нагревании, действии растворов солей тяжёлых металлов, кислот и щелочей. При денатурации белок сворачивается и выпадает в осадок.
Ксантопротеиновая реакция – качественная цветная реакция концентрированной азотной кислоты с белками, содержащими остатки ароматических аминокислот. При добавлении концентрированной азотной кислоты к белку и нагревании сначала происходит денатурация белка, а затем появляется жёлтое окрашивание.
- Олигопептиды – органические соединения, состоящие из 10–20 остатков аминокислот, связанных пептидными связями.
- Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода.
- Пептидная связь – связь между атомами углерода и азота в пептидной группе.
- Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью.
- Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
- ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
- Аминокислоты – это азотсодержащие органические соединения, в состав которых входят как аминогруппа, так и карбоксильная группа
- Простейшим представителем аминокислот является глицин – аминоуксусная (аминоэтановая) кислота
- По международной номенклатуре нумерация углеродных атомов начинается от углерода карбоксильной группы.
Достаточно часто в литературе можно встретить обозначения углеродных атомов в аминокислотах с помощью букв греческого алфавита. При этом атом углерода карбонильной группы не имеет обозначения.
Для некоторых аминокислот существуют тривиальные названия.
Изомеры аминокислот различаются строением углеводородного радикала и положением аминогруппы.
Все α-аминокислоты, кроме глицина, имеют в своем составе асимметрический атом, который следует сразу за карбоксильной группой. У этого атома углерода все заместители разные.
Благодаря этому атому, для α-аминокислот характерна оптическая изомерия. В природе распространены только L-α-аминокислоты.
Биологическое значение аминокислот
Из аминокислот наибольшее значение имеют α-аминокислоты, так как они входят в состав белковых молекул, из которых построено всё живое вещество.
Растения и бактерии способны самостоятельно синтезировать все необходимые для них аминокислоты. Млекопитающие, в том числе и человек, не могут синтезировать ряд аминокислот, они должны поступать в организм с пищей. К таким незаменимым аминокислотам относятся метионин, треонин, фенилаланин, лейцин, изолейцин, валин, лизин, триптофан.
α-Аминокислоты необходимы человеку для образования белков. Большую часть аминокислот для этих целей человек получает с пищей. Некоторые аминокислоты можно синтезировать. Для регулирования обменных процессов аминокислоты применяются как лекарства (например, глицин).
- Получение аминокислот
- В промышленности α-аминокислоты получают гидролизом белков.
- Можно синтезировать аминокислоты из хлорпроизводных карбоновых кислот и аммиака.
- Cl-CH2-COOH + 2NH3 → NH2-CH2-COOH + NH4Cl
- Физические и химические свойства аминокислот
Аминокислоты – кристаллические вещества без цвета и запаха, сладковатые на вкус. Хорошо растворяются в воде.
Аминокислоты – амфотерные соединения, так как аминогруппа проявляет основные свойства, а карбоксильная группа – кислотные.
Карбоксильная группа в составе аминокислот позволяет им реагировать со спиртами. В результате реакции образуются сложные эфиры.
- Ион водорода от карбоксильной группы может переходить к аминогруппе, в результате образуется биполярный ион.
- Пептиды
- Аминокислоты могут реагировать друг с другом, аминогруппа одной кислоты соединяется с карбоксильной группой другой кислоты, при этом происходит выделение воды.
- Группа атомов СО-NH называется пептидной (или амидной) группой, а связь между атомами углерода и азота – пептидной (амидной) связью.
- Соединения, образованные из нескольких аминокислот с помощью пептидной связи, называются пептидами.
Называют пептиды перечислением тривиальных названий аминокислот, входящих в состав пептида, начиная с аминокислотного остатка со свободной аминогруппой (N-конец), заменяя в названии аминокислот окончание «ин» на «ил». Последней называют аминокислоту со свободной карбоксильной группой (С-конец), её название не изменяется. Часто название пептида записывают с помощью трёхбуквенных латинских сокращённых наименований аминокислот.
Молекулы, в состав которых входит 10–20 остатков аминокислот, называют олигопептидами.
Макромолекулы, образованные 20–50 остатками аминокислот называют полипептидами.
Полипептиды входят в состав многих гормонов. Нейропептиды регулируют работу мозга, процессы сна, обучения, обладают обезболивающим эффектом.
Белки
Полипептиды, содержащие в своём составе более 50 остатков аминокислот, называются белками. Это природные полимеры, которые образуют клетки всех живых организмов. Без белков невозможны обмен веществ, размножение и рост живых организмов.
Белки образованы атомами углерода, водорода, кислорода и азота. Кроме этих атомов, макромолекулы белков могут содержать атомы фосфора, серы, железа и других элементов.
- Относительная молекулярная масса белковых молекул может быть от нескольких десятков до сотен атомных единиц массы.
- Структура белков
- Последовательность остатков аминокислот в молекуле белка образует первичную структуру белка.
Между атомом кислорода в группе С=О и атомом водорода в амидной группе – NH – образуется водородная связь, в результате чего макромолекула белка закручивается в спираль. Образуется вторичная структура белка.
Функциональные группы, расположенные на внешней стороне спирали, могут взаимодействовать с другими функциональными группами этой же макромолекулы. Например, между атомами серы образуется сульфидный мостик, между карбоксильной и гидроксильной группами возникает сложноэфирный мостик.
В результате образуется третичная структура белка, которая определяет специфическую биологическую активность белков. Именно благодаря уникальной третичной структуре биологические катализаторы – ферменты обладают уникальной избирательностью.
- Благодаря различным функциональным группам белковые молекулы могут соединяться друг с другом, в результате формируется четвертичная структура белка.
- Химические свойства белков
- В зависимости от молекулярной массы и функциональных групп белки могут как хорошо растворяться в воде, так и не растворяться в ней.
- Под действием температуры, растворов солей тяжёлых металлов, кислот и щелочей происходит разрушение вторичной, третичной и четвертичной структуры белка, называемое денатурацией.
- При нагревании в присутствии кислоты или щёлочи белки подвергаются гидролизу, распадаясь на исходные аминокислоты.
Белки в щелочной среде в присутствии сульфата меди (II) окрашивают раствор в красно-фиолетовый цвет. Это реакция на пептидную группу (биуретовая реакция).
Концентрированная азотная кислота при нагревании окрашивает белки в жёлтый цвет, если в состав белка входят остатки ароматических аминокислот, например, фенилаланина (ксантопротеиновая реакция).
Для обнаружения в составе белка атомов серы проводят реакцию с ацетатом свинца в щелочной среде при нагревании. В результате образуется чёрный осадок (цистеиновая реакция).
Превращения белков в организме
Белки являются обязательными компонентами в пищевом рационе человека. В организме человека белки, поступившие с пищей, под действием ферментов подвергаются гидролизу и разлагаются на отдельные аминокислоты.
Эти аминокислоты – строительный материал для образования новых белков, необходимых человеку. Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов.
Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Успехи в изучении и синтезе белков
В 1954 г. британский биолог Фредерик Сенгер впервые расшифровал строение белка инсулина. Каждая молекула инсулина состоит из двух полипептидов, в одном из которых 21 остаток аминокислоты, а в другом – 30 аминокислотных остатков.
В 1967 г. был создан прибор – секвенатор, позволяющий определять последовательность остатков аминокислот в макромолекуле белка.
Первый белок, синтезированный в лаборатории в 1953 г. был окситоцин.
В настоящее время развивается наука, которая занимается синтезом искусственных белков, – генная инженерия.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на вычисление массовой доли элемента в молекуле аминокислоты.
Условие задачи: вычислите массовую долю азота в молекуле аспаргина
Шаг первый: вычислить относительную молекулярную массу молекулы аспаргина:
М = 4·12 + 8·1 + 2·14 + 3·16 = 132 а.е.м.
Шаг второй: определить количество атомов азота в молекуле аспаргина и определить их относительную атомную массу:
2·14 = 28 а.е.м.
- Шаг третий: определить массовую долю азота как отношение относительной атомной массы азота к относительной молекулярной массе аспаргина:
- (28 : 132)·100 = 21,2 %.
- Ответ: 21,2.
2. Решение задачи на определение количества различных олигопептидов, которые можно получить из определённого набора аминокислот.
- Условие задачи: Сколько ди- и трипептидов можно составить из двух молекул аланина и одной молекулы цистеина?
- Шаг первый: определить количество возможных дипептидов.
- Из двух молекул аланина и одной молекулы цистеина можно составить три дипептида: Ala-Ala, Ala-Cys и Cys-Ala (два последних дипептида – разные соединения, так как в молекуле Ala-Cys карбоксильная группа аланина соединяется с аминогруппой цистеина, а в молекуле Cys-Ala карбоксильная группа цистеина соединяется с аминогруппой аланина).
- Шаг второй: определить количество возможных трипептидов.
- Ala-Ala-Cys, Ala-Cys-Ala, Cys-Ala-Ala – возможно составить 3 трипептида.
- Ответ: 3 дипептида и 3 трипептида.
§ 6. Аминокислоты как структурные элементы белков
- Глава III. БЕЛКИ
- § 6. АМИНОКИСЛОТЫ КАК СТРУКТУРНЫЕ ЭЛЕМЕНТЫ БЕЛКОВ
- Природные аминокислоты
Аминокислоты в живых организмах встречаются преимущественно в составе белков.
Белки построены в основном двадцатью стандартными аминокислотами. Они являются a-аминокислотами и отличаются друг от друга строением боковых групп (радикалов), обозначаемых буквой R:
Разнообразие боковых радикалов аминокислот играет ключевую роль при формировании пространственной структуры белков, при функционировании активного центра ферментов.
Структура стандартных аминокислот приведена в конце параграфа в табл.3. Природные аминокислоты имеют тривиальные названия, оперировать которыми при записях структуры белков неудобно. Поэтому для них введены трехбуквенные и однобуквенные обозначения, которые также представлены в табл.3.
Пространственная изомерия
У всех аминокислот, за исключением глицина, a-углеродный атом является хиральным, т.е. для них характерна оптическая изомерия. В табл. 3 хиральный атом углерода обозначен звездочкой. Например, для аланина проекции Фишера обоих изомеров выглядят следующим образом:
Для их обозначения, как и для углеводов, используется D, L-номенклатура. В состав белков входят только L-аминокислоты.
L- и D-изомеры могут взаимно превращаться друг в друга. Этот процесс называется рацемизацией.
Интересно знать! В белке зубов – дентине – L-аспарагиновая кислота самопроизвольно рацемизуется при температуре человеческого тела со скорость 0,10 % в год.
В период формирования зубов в дентине содержится только L-аспарагиновая кислота, у взрослого же человека в результате рацемизации образуется D-аспарагиновая кислота. Чем старше человек, тем выше содержание D-изомера.
Определив соотношение D- и L-изомеров, можно достаточно точно установить возраст. Так были изобличены жители горных селений Эквадора, приписывавшие себе слишком большой возраст.
Химические свойства
Аминокислоты содержат амино- и карбоксильную группы. В силу этого они проявляют амфотерные свойства, то есть свойства и кислот и оснований.
При растворении аминокислоты в воде, например, глицина, его карбоксильная группа диссоциирует с образованием иона водорода. Далее ион водорода присоединяется за счет неподеленной пары электронов у атома азота к аминогруппе. Образуется ион, в котором одновременно присутствуют положительный и отрицательный заряды, так называемый цвиттер-ион:
Такая форма аминокислоты является преобладающей в нейтральном растворе. В кислой среде аминокислота, присоединяя ион водорода, образует катион:
В щелочной среде образуется анион:
Таким образом, в зависимости от рН среды аминокислота может быть положительно заряженной, отрицательно заряженной и электронейтральной (при равенстве положительных и отрицательных зарядов).
Значение рН раствора, при котором суммарный заряд аминокислоты равен нулю, называется изоэлектрической точкой данной аминокислоты. Для многих аминокислот изоэлектрическая точка лежит вблизи рН 6.
Например, изоэлектрические точки глицина и аланина имеют значения 5,97 и 6,02 соответственно.
Две аминокислоты могут реагировать друг с другом, в результате чего отщепляется молекула воды и образуется продукт, который называется дипептидом:
Связь, соединяющая две аминокислоты, носит название пептидной связи. Если пользоваться буквенными обозначениями аминокислот, образование дипептида можно схематически представить следующим образом:
Аналогично образуются трипептиды, тетрапептиды и т.д.:
- H2N – лиз – ала – гли – СООН – трипептид
- H2N – трп – гис – ала – ала – СООН – тетрапептид
- H2N – тир – лиз – гли – ала – лей – гли – трп – СООН – гептапептид
- Пептиды, состоящие из небольшого числа аминокислотных остатков, имеют общее название олигопептиды.
Интересно знать! Многие олигопептиды обладают высокой биологической активностью. К ним относится ряд гормонов, например, окситоцин (нанопептид) стимулирует сокращение матки, брадикинин (нанопептид) подавляет воспалительные процессы в тканях.
Антибиотик грамицидин С (циклический декапептид) нарушает регуляцию ионной проницаемости в мембранах бактерий и тем самым убивает их. Грибные яды аманитины (октапептиды), блокируя синтез белка, способны вызвать сильное отравление у человека. Широко известен аспартам – метиловый эфир аспартилфенилаланина.
Аспартам имеет сладкий вкус и используется для придания сладкого вкуса различным продуктам, напиткам.
- Классификация аминокислот
- Существует несколько подходов к классификации аминокислот, но наиболее предпочтительной является классификация, основанная на строении их радикалов. Выделяют четыре класса аминокислот, содержащих радикалы следующих типов; 1) неполярные (или гидрофобные); 2) полярные незаряженные; 3) отрицательно заряженные и 4) положительно заряженные:
- К неполярным (гидрофобным) относятся аминокислоты с неполярными алифатическими (аланин, валин, лейцин, изолейцин) или ароматическими (фенилаланин и триптофан) R-группами и одна серусодержащая аминокислота – метионин.
Полярные незаряженные аминокислоты в сравнении с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие полярную НО-группу (серин, треонин и тирозин), HS-группу (цистеин), амидную группу (глутамин, аспарагин) и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам. Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин, в ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
Десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в человеческом организме. Остальные должны содержаться в нашей пище.
К ним относятся аргинин, валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин и гистидин. Эти аминокислоты называются незаменимыми.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Интересно знать! Исключительно важную роль играет сбалансированность питания человека по аминокислотам. При недостатке незаменимых аминокислот в пище организм саморазрушается.
При этом страдает в первую очередь головной мозг, что приводит к различным заболеваниям центральной нервной системы, психическим расстройствам. Особенно уязвим молодой растущий организм.
Так, например, при нарушении синтеза тирозина из фенилаланина у детей развивается тяжелое заболевание финилпировиноградная олигофрения, вызывающее тяжелую умственную отсталость или гибель ребенка.
Таблица 3
Стандартные аминокислоты
| Аминокислота (тривиальное название) | Условные обозначения | Структурная формула | |
| Русское | Латинское | ||
| трехбук- венное | однобук-венное | ||
| НЕПОЛЯРНЫЕ (ГИДРОФОБНЫЕ) | |||
| Аланин | Ала | Ala | A |
| Валин | Вал | Val | V |
| Лейцин | Лей | Leu | L |
| Изолейцин | Иле | Ile | I |
| Пролин | Про | Pro | P |
| Фенилаланин | Фен | Phe | F |
| Триптофан | Трп | Trp | W |
| Метионин | Мет | Met | M |
| ПОЛЯРНЫЕ НЕЗАРЯЖЕННЫЕ | |||
| Серин | Сер | Ser | S |
| Треонин | Тре | Thr | T |
| Аспарагин | Асн | Asn | N |
| Глутамин | Глн | Gln | Q |
| Цистеин | Цис | Cys | C |
| Тирозин | Тир | Tyr | Y |
| Глицин | Гли | Gly | G |
| ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫЕ | |||
| Аспарагиновая кислота | Асп | Asp | D |
| Глутаминовая кислота | Глу | Glu | E |
| ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННЫЕ | |||
| Лизин | Лиз | Lys | K |
| Аргинин | Арг | Arg | R |
| Гистидин | Гис | His | H |
Примечание: * хиральный атом углерода.
Какие аминокислоты входят в состав белков?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций.
Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста.
Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Сколько аминокислот входит в состав белков, как они называются?
Белок является главным строительным материалом для организма. Его структура сложная и многоступенчатая. Какие аминокислоты входят в его состав?
Белок очень важен для организма, так как является строительным материалом. Его основой являются аминокислоты. Эти вещества отвечают за разные функции и нужны для поддержания нормального состояния организма.
Основные свойства аминокислот
Аминокислоты обладают следующими свойствами:
- Быстро и хорошо растворяются в жидкой среде.
- По форме напоминают кристаллы.
- При воздействии высоких температур могут расплавиться.
- Имеют некоторые признаки кислот и оснований одновременно.
- Получаются в процессе белкового гидролиза.
Для чего аминокислоты нужны организму?
Биологическая роль аминокислот заключается в следующем:
- обеспечивают правильную работу иммунной системы;
- синтезируют глюкозу и участвуют в углеводном обмене;
- выступают в роли строительного материала для мышц и сухожилий;
- помогают спортсменам при наборе мышечной массы;
- поддерживают здоровье соединительных тканей;
- помогают поврежденным тканям быстрее восстановиться;
- участвуют в выработке энергии;
- выводят из организма вредные вещества и токсины;
- участвуют в образовании гормонов;
- поддерживают печень в порядке;
- помогают поддерживать нормальную работу головного мозга;
- обеспечивают бодрость духа и хорошее настроение;
- повышают работоспособность человека и его творческий потенциал;
- помогают нервным клеткам защититься от вредного воздействия алкогольных напитков;
- улучшают психическое здоровье человека;
- участвуют в жировом обмене;
- поддерживают работу органов желудочно-кишечного тракта;
- регулируют работу щитовидной железы;
- поддерживают в норме массу тела;
- замедляют естественные процессы старения.
Сколько аминокислот входит в состав белков?
В состав белков входят следующие незаменимые аминокислоты:
- Лейцин, нужный для набора мышечной массы и контроля массы тела.
- Изолейцин, стимулирующий выделение энергии.
- Лизин, отвечающий за укрепление иммунитета и повышение защитных сил организма.
- Фенилаланин, обеспечивающий правильную работу центральной нервной системы.
- Метионин, ответственный за эффективное и быстрое сжигание подкожного жира.
- Треонин, оказывающий положительное влияние на центральную нервную систему.
- Триптофан, формирующий полезные для жизнедеятельности гормоны.
- Валин, ускоряющий процессы обмена веществ.
Также белок образуют несколько заменимых аминокислот. К ним относятся:
- Аланин, необходимый для процессов углеводного обмена и выведения из организма токсических веществ.
- Аспарагиновая кислота, обеспечивающая человеку энергичность и прилив бодрости.
- Аспарагин, обеспечивающий работу центральной нервной системы и головного мозга.
- Гистидин, вырабатывающий кровяные тельца красного цвета.
- Серин, отвечающий за правильную и эффективную работу головного мозга и за протекание когнитивных процессов.
- Цистеин, подающий в организм кератин.
- Аргинин, оздоравливающий кожу, кости, мышечную ткань и сухожилия.
- Глютаминовая кислота, без которой невозможна нормальная работа головного и спинного мозга.
- Глютамин, предотвращающий атрофию мышечных волокон.
- Глицин, ускоряющий процессы свертываемости крови.
- Пролин, стимулирующий выработку коллагена.
- Тирозин, поддерживающий в норме аппетит и артериальное давление.
Внимание! В состав белков входят разные аминокислоты, заменимые и незаменимые. Они обеспечивают правильное формирование протеинов и эффективную работу всего организма.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций.
Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста.
Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
20 основных аминокислот с химическими формулами
Определение 1
Аминокислоты (АМК, аминокорбоновые кислоты, пептиды) – органические соединения на основе аминов, под которыми подразумеваются производные аммония 16%.
Аминокислоты играют важную роль — принимают участие в биосинтезе белка. Расщепление белка на аминокислоты происходит в желудочно-кишечном тракте человека.
Сколько существует аминокислот? Сегодня известно около двухсот пептидов, но всего 20 аминокислот принимают участие в строительстве биологического организма.
Поэтому если перед вами стоит вопрос, как запомнить аминокислоты, не стоит паниковать: нужно запомнить всего 20.
Есть заменимые и незаменимые аминокислоты. Также некоторые выделяют условно заменимые аминокислоты.
Заменимые аминокислоты
Определение 2
Заменимые аминокислоты — те аминокислоты, которые попадают в организм человека вместе с продуктами питания.
В самом человеке они тоже могут производиться — из прочих веществ.
Среди таких аминокислот выделяются:
- аланин. Это мономер белков. Он принимает участие в процессе глюкогенеза, становясь глюкозой в человеческой печени. Отвечает за регулирование метаболических процессов;
- аргинин. Синтезируется только в организме взрослых людей — в организме детей образоваться не может. Играет важную роль, к примеру, в системе синтеза гормона роста. Единственная аминокислота, переносящая азот. С ее помощью увеличивается мышечная масса и снижается жировая;
- аспарагин. Является пептидом азотного обмена. Действуя с ферментами, отщепляет аммониак и преобразуется в аспарагиновую кислоту;
- аспарагиновая кислота. Отвечает за образование иммуноглобулинов и деактивацию аммиака. Помогает восстановить баланс в работе сердечного цикла и нервной системы;
- гистидин. Применяют в лечении кишечных заболеваний и в качестве профилактики СПИДа. Уменьшает негативное влияние на человеческий организм стрессовых факторов;
- глицин. Нейромедиатор. Успокаивает;
- глутамин. Составляющая гемоглобина. Отвечает за стимуляцию метаболизма в ЦНС;
- глютаминовая кислота. Отвечает за регуляцию периферической нервной системы;
- пролин. Есть в составе протеинов. Например, в коллагене и эластине;
- серин. Аминокислота, которую можно найти в нейронах головного мозга. Облегчает выработку и высвобождение энергии. Возникает из глицина;
- тирозин. Из этой аминокислоты состоят, в том числе, растительные и животные ткани. В некоторых случаях восстанавливаются из фенилаланина;
- цистеин. Компонент кератина. Принадлежит к антиоксидантам. В отдельных случаях воспроизводится из серина.
Замечание 1
Описанные функции кислот не являются полными и могут быть продолжены.
Незаменимые аминокислоты
Определение 3
Незаменимые аминокислоты — те, синтез которых человеческим организмом не предусмотрен.
Содержатся в отдельных продуктах и поступают в организм с приемом пищи.
В список аминокислот, которые в организме не вырабатываются, входят:
- валин. Повышает координацию функционирования мышц, обеспечивает устойчивость организма к изменениям температуры;
- изолейцин. Его еще называют естественным анаболиком. Отвечает за насыщение мышц необходимой энергией;
- лейцин. Отвечает за регуляцию всех процессов метаболизма. Важный участник процесса построения белковой структуры. Вместе с двумя описанными выше аминокислотами составляет комплекс BCAA (который отвечает за построение мышечной массы). Эта аминокислота, и комплекс в целом, важна для людей, занимающихся спортом. Она помогает увеличить мышечную массу, понизить уровень развития ПЖК (подкожно-жировая клетчатка), поддерживать гомеостаз при больших физнагрузках;
- лизин. Его наличие в организме влияет на улучшение регенерации тканей, выработку гормонов, антител и ферментов. Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
- метионин. Принимает участи в синтезе холина. Сокращает количество жира в печени;
- треонин. Отвечает за укрепление сухожилий и эмали зубов;
- триптофан. Помогает в регуляции эмоционального состояния, лечении психических расстройств личности;
- фениалалнин. Принимает участие в регуляции деятельности кожных покровов путем снижения их пигментации. Восстанавливает водно-солевой баланс верхних слоев кожи.
Нужна помощь преподавателя? Опиши задание — и наши эксперты тебе помогут!