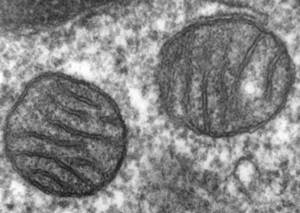
Тромбоциты, иликровяные пластинки — утолщённые, безъядерные пластинки диаметром (3)–(4) мкм. Число тромбоцитов в крови не постоянно.
В разное время в (1) мм³ их может насчитываться (200) до (400) тыс. Образование тромбоцитов происходит постоянно, образуются они в красном костном мозге.
Кровяные пластинки живут несколько дней, а затем разрушаются в селезёнке.
Тромбоциты — это клетки системы свёртывания крови. Они выполняют свою функцию при кровотечениях. Особенностью тромбоцитов является способность изменять форму и прикрепляться к поверхности сосуда с образованием тромба (сгустка крови).
Рис. (1). Тромбоциты
Свёртывание крови — это защитная реакция организма. Она обеспечивает остановку кровотечения при повреждении кровеносного сосуда.
Потеря большого количества крови может быть смертельно опасной. Для женщин возникает опасность для жизни при потере (2,5) л крови, а для мужчин эта цифра меньше — (1,5)–(2,0) л крови.
Свёртывание крови — многоступенчатый процесс, включающий последовательное выделение из клеток крови и разрушенных сосудов более (10) веществ, так называемых факторов свёртывания крови.
При повреждении сосуда (например, при порезе) тромбоциты, находящиеся в этом месте, разрушаются и выделяют протромбин, под действием которого содержащийся в крови растворимый белок фибриноген превращается в нерастворимый фибрин.
Длинные нити фибрина переплетаются между собой в сеть, где задерживаются форменные элементы крови, и образуется тромб, перекрывающий рану и прекращающий кровотечение. Образование тромба происходит в течение (3)–(8) мин.
Со временем стенка сосуда восстанавливается, а тромб рассасывается.
Рис. (2). Образование тромба
При свёртывании крови вне организма, после отделения от неё кровяного сгустка, образуется сыворотка крови. Сыворотка почти соответствует плазме по составу крови, но в ней отсутствует фибриноген.
Рис. (3). Отстаивание крови
Нарушения свёртываемости крови
Если в крови отсутствуют факторы свертывания или их недостаточно, то любое кровотечение становится опасным для жизни. Одно из нарушений свёртываемости крови — гемофилия. Это наследственное заболевание, связанное с изменением генов. Гемофилией болеют мужчины, а наследуется она по женской линии.
Рис. (4). Наследование гемофилии
Пример:
сын последнего Российского императора Николая (II) — цесаревич Алексей — страдал гемофилией, которую он унаследовал от матери — императрицы Александры Фёдоровны (внучатой племянницы английской королевы Виктории, носительницы гена гемофилии).
Для свёртывания крови нужны соли кальция. Их недостаток в организме тоже может привести к нарушению свёртываемости крови.
Источники:
Рис. 1. Тромбоциты: https://image.shutterstock.com/image-illustration/red-blood-cellsactivated-platelet-white-600w-313800662.jpg
Рис. 2. Образование тромба: © ЯКласс
Рис. 3. Отстаивание крови: © ЯКласс
Рис. 4. Наследование гемофилии: https://image.shutterstock.com/image-illustration/xlinked-recessive-inheritance-means-that-600w-1286371987.jpg
Как тромбоциты ускоряют свёртывание крови • Библиотека
Если посмотреть на каплю крови в микроскоп (пусть это будет световой микроскоп, но достаточно мощный), то можно увидеть клетки трёх типов: многочисленные эритроциты, или красные кровяные тельца, немногочисленные, но довольно крупные лейкоциты и мельчайшие тромбоциты, которые удаётся разглядеть с некоторым трудом.
Эритроциты, плотно набитые белком гемоглобином, переносят кислород: гемоглобин связывает его в лёгких и отдаёт в тканях и органах, которые в нём нуждаются. Лейкоциты — клетки иммунной системы, и они вместе с иммунными белками защищают нас от инфекций и от некоторых неинфекционных заболеваний, например от рака.
Лейкоцитов существует несколько типов, отличающихся в том числе и по численности; возможно, из лейкоцитов нам попадутся Т-лимфоциты, которые целенаправленно распознают и сами уничтожают как чужеродные, так и наши собственные клетки, которым не повезло заболеть. Наконец, тромбоциты.
Про тромбоциты мы знаем, что они нужны для свёртывания крови.
Кто не представляет, как работает система свёртывания крови? Уколовши палец, мы наблюдаем, как он сначала кровоточит, а потом перестаёт — образовавшийся тромб остановил кровь. Если бы кровь не свёртывалась, то разбитый нос мог бы оказаться смертельным ранением.
Но, наверно, едва ли не более важная функция механизма свёртывания — предотвращение внутренних кровотечений, которые часто случаются при различных заболеваниях (например, при тяжёлой инфекции или при злокачественной опухоли).
При этом система свёртывания должна быть очень точно сбалансирована: если она будет работать плохо, то пойдут неостанавливаемые кровотечения, внутренние и наружные; если же механизм свёртывания будет слишком активным, начнут формироваться тромбы, грозящие закупоркой сосудов и остановкой кровоснабжения.
В медицине есть масса примеров, когда процессы свёртывания крови и тромбообразования идут не так, как надо, и не там, где надо. Причиной тому могут быть либо другие болезни, и тогда нарушения системы свёртывания крови — это просто сопутствующий симптом, либо же сами эти нарушения представляют собой отдельные, самостоятельные заболевания (вроде небезызвестной гемофилии или болезни Виллебранда).
Бороться с аномалиями системы свёртывания можно по-разному, и сейчас есть медицинские средства, которые позволяют эффективно регулировать её работу. Но чтобы такие средства работали ещё лучше, чтобы сделать их ещё более совершенными, нужно как можно точнее знать, как на молекулярно-клеточном уровне устроен механизм свёртывания крови.
Его изучают уже более ста лет, и сейчас его схему можно найти в любом школьном учебнике; правда, схему эту большинство из нас старается забыть, как страшный сон: ещё бы, около двух десятков белков, соединённых стрелками, — кто-то кого-то активирует, кто-то кого-то ингибирует.
Однако если рассматривать свёртывание по этапам, то всё становится более или менее понятно.
Стоит сразу сказать, что собственно свёртывание — лишь часть более общего процесса гемостаза (от греч. haimatos — кровь, stasis — остановка). И этот процесс начинается как раз с тромбоцитов. Они происходят от мегакариоцитов — гигантских клеток костного мозга.
От зрелых мегакариоцитов «отшнуровываются» куски цитоплазмы, которые и становятся безъядерными клетками тромбоцитами (хотя, учитывая их происхождение и отсутствие ядра, более корректно называть их просто тельцами крови или кровяными пластинками). Тромбоциты циркулируют по крови, пока не «заметят» брешь в сосуде. Сигналом для них служит соединительнотканный белок коллаген.
Он обычно спрятан внутри стенки сосуда, но при её повреждении оказывается лицом к лицу с тромбоцитами и другими белками крови. На мембране тромбоцитов есть специальный рецептор, который хватает коллаген и заставляет кровяные пластинки прилипнуть к месту повреждения. Тут в дело вступает один из факторов свёртывания под названием «фактор фон Виллебранда».
Это гликопротеин (его молекула состоит из белковой и углеводной частей), который помогает другим рецепторам тромбоцитов зацепиться за торчащий из стенки сосуда коллаген.
Благодаря фактору фон Виллебранда тромбоциты не только прочнее взаимодействуют с местом повреждения, но и дополнительно активируются — подают молекулярные сигналы другим тромбоцитам и белкам свёртывания, меняют внешнюю форму и активно слипаются друг с другом. В результате на стенке кровеносного сосуда появляется затычка из тромбоцитов.
Одновременно с формированием тромбоцитарной пробки происходит процесс собственно свёртывания крови — свёртывания в строгом смысле слова. В нём участвует множество белков плазмы крови, большинство из них — ферменты-протеазы, то есть белки, отщепляющие куски от других белков.
Если до расщепления «жертва» протеазы была неактивным белком-ферментом, то после расщепления фермент активируется и, если он сам протеаза, тоже может кого-то расщепить.
Суть ферментативных реакций, которые идут во время свёртывания, в том, что белки активируют друг друга, и в итоге всё заканчивается появлением активного белка фибрина, который быстро полимеризуется, превращаясь в нити — фибриллы.
Из нитей фибрина формируется фибриновый сгусток, дополнительно укрепляющий тромбоцитовую «затычку», — образуется тромбоцитарно-фибриновый тромб. Когда сосуд восстанавливается, тромб рассасывается.
Оба этапа — и формирование тромбоцитарной пробки, и свёртывание крови с участием плазматических факторов-ферментов — подчиняются множеству регуляторов.
Для организма важно, чтобы система гемостаза работала как можно более точно, и многостадийность как раз помогает выполнять тонкую настройку: на каждом этапе, на каждой реакции ферменты и другие молекулы, задействованные в процессе, проверяют, не ложный ли сигнал к ним пришёл и действительно ли есть необходимость в тромбе. Естественно, тромбоциты и факторы свёртывания теснейшим образом связаны друг с другом и тромбоциты нужны не только для того, чтобы первыми заткнуть брешь в сосуде. Во-первых, они также выделяют белки, которые ускоряют восстановление стенки сосуда. Во-вторых, что особенно важно, кровяные пластинки нужны ещё для того, чтобы ферменты свёртывания продолжали работать.
После запуска процесса гемостаза мембрана некоторых тромбоцитов изменяется особым образом, так что теперь на неё могут садиться ферменты реакций свёртывания: после приземления на такие тромбоциты они начинают работать намного быстрее. Что при этом происходит, удалось выяснить лишь относительно недавно.
Активированные тромбоциты, то есть те, которые почувствовали повреждение сосуда, бывают двух форм: простые (агрегирующие) и сверхактивированные (прокоагулянтные).
Простые агрегирующие тромбоциты отчасти похожи на амёбы: они образуют выпячивания мембраны, похожие на ножки, которые помогают им лучше сцепляться друг с другом, и становятся более плоскими, как бы растекаясь по поверхности. Такие клетки формируют основное тело тромба.
Сверхактивированные тромбоциты ведут себя иначе: они приобретают сферическую форму и увеличиваются в несколько раз, становясь похожими на воздушные шарики. Они не просто укрепляют тромб, но и стимулируют реакцию свёртывания, почему их и называют прокоагулянтными.
Как одни тромбоциты становятся простыми, а другие — сверхактивированными? Известно, что в прокоагулянтных тромбоцитах очень высок уровень кальция (ионы кальция вообще один из главных регуляторов гемостаза) и что у них выходят из строя митохондрии. Связаны ли эти изменения в клеточной физиологии со сверхактивацией тромбоцитов?
В прошлом году Фазли Атауллаханов*, директор Центра теоретических проблем физико-химической фармакологии РАН, вместе с Михаилом Пантелеевым, заведующим лабораторией молекулярных механизмов гемостаза центра и профессором кафедры медицинской физики физического факультета МГУ, опубликовали в журнале Molecular BioSystems статью с описанием модели митохондриального некроза как особой формы клеточной смерти. Мы знаем, что клетка может погибнуть в результате апоптоза, включив программу самоуничтожения (при апоптозе всё происходит по плану и с минимальным беспокойством для клеток-соседей), или в результате некроза, когда гибель случается быстро и незапланированно, например из-за разрыва наружной мембраны или из-за масштабных внутренних неприятностей, вроде вирусной или бактериальной инфекции.
В чём особенность митохондриального некроза? Митохондрии, как известно, служат источниками энергии для любой нашей клетки: в митохондриях происходит кислородное окисление «питательных» молекул, а освобождённая при этом энергия запасается в удобной для клетки форме. Побочным продуктом при работе с кислородом оказываются агрессивные кислородные радикалы, которые могут испортить любую биомолекулу. Сами митохондрии стараются уменьшать концентрацию радикалов и не выпускать их из себя в клеточную цитоплазму.
При митохондриальном некрозе происходит следующее: митохондрии вбирают в себя кальций, и в какой-то момент, когда кальция становится слишком много, они разрушаются, выплёскивая в цитоплазму и кальций, и активные формы кислорода.
В результате в клетке распадается внутриклеточный белковый скелет и клетка сильно увеличивается в объёме, превращаясь в шар. (Как мы помним, шарообразная форма характерна для сверхактивированных тромбоцитов.
) Кроме того, и ионы кальция, и активные формы кислорода активируют фермент скрамблазу, который перебрасывает фосфатидилсерин — один из липидов цитоплазматической мембраны — из внутреннего слоя мембраны в наружный.
И вот на такую модифицированную мембрану округлившихся тромбоцитов, обогащённую фосфатидилсерином, прилипают некоторые важные факторы свёртывания: здесь они собираются в комплексы, активируются, и в результате реакция свёртывания ускоряется в 1000–10 000 раз.
В новой статье, опубликованной в июне этого года в Journal of Thrombosis and Haemostasis, Михаил Пантелеев, Фазли Атауллаханов и их коллеги описывают эксперименты, которые полностью подтверждают такую модель активации тромбоцитов: кровяные пластинки стимулировали тромбином, одним из белков системы свёртывания, после чего митохондрии наполнялись ионами кальция, а в митохондриальных мембранах появлялись поры. Проницаемость митохондрий увеличивалась, и в какой-то момент, когда изменение проницаемости делалось необратимым, весь запасённый кальций оказывался в цитоплазме и запускал процесс «переформатирования» наружной мембраны.
Получается следующая картина: тромбоциты, подчиняясь внешним активаторам, впитывают кальций. Из их цитоплазмы кальций переходит в митохондрии.
В самой цитоплазме уровень ионов кальция то повышается, то понижается (осциллирует), но в митохондриях он неуклонно растёт, и наступает момент, когда они уже не могут удерживать кальциевые ионы внутри себя.
Весь кальций (с кислородными окислителями) выходит в цитоплазму и включает фермент, перебрасывающий липиды в цитоплазматической мембране тромбоцита. В результате на поверхности сверхактивированного и, очевидно, доживающего свои последние минуты тромбоцита собираются ферментативные комплексы, ускоряющие реакцию свёртывания.
Почему же не все тромбоциты становятся сверхактивированными — прокоагулянтными? Вероятно, потому, что для активации требуется сумма сигналов от разных регуляторов.
Мы уже сказали, что тромбоциты чувствительны к тромбину, который плавает в плазме крови, а в начале статьи говорили, что одним из первых активирующих сигналов для кровяных пластинок служит коллаген из повреждённой стенки сосуда. Коллаген и тромбин действительно сильные активаторы, но кроме них тромбоциты «прислушиваются» и к некоторым другим молекулам.
Степень активации зависит от количества разных входных сигналов, и превращение в прокоагулянтную форму, очевидно, происходит тогда, когда суммарный сигнал извне оказывается для конкретного тромбоцита особенно сильным.
Практические аспекты полученных результатов понятны каждому: чем больше подробностей узнаем про свёртывание крови, тем скорее научимся управлять этим процессом, ускоряя или замедляя его в соответствии с медицинскими показаниями.
* Интервью с Фазли Атауллахановым, «Наука и жизнь» № 1, 2011 г.
Анализ на свертываемость крови (коагулограмма) | Университетская клиника
Анализ на свертываемость крови (гемостаз, коагулограмма) позволяет определить основные факторы этого процесса. Исследование выявляет причины кровотечений, тромбов и служит обязательным этапом подготовки к операциям и многим процедурам.
Как и почему сворачивается кровь
В человеческом теле находится примерно 7% крови. То есть при весе в 80 кг – 5,6 л. Потеря половины объёма считается смертельной. При массивном кровотечении 2,8 л можно потерять за достаточно короткое время.
Чтобы такого не произошло, в организме имеется система гемостаза. Биологический механизм сворачивает кровь с образованием нерастворимого сгустка, запечатывающего поврежденные сосуды.
Это предотвращает развитие смертельно опасной кровопотери.
Ключевую роль в остановке кровотечения играют кровяные клетки – тромбоциты, образующиеся в костном мозге. В их клеточной мембране находятся рецепторы, реагирующие на белки, образующиеся при сосудистом повреждении.
В ответ на начавшееся кровотечение происходит слипание (адгезия) тромбоцитов, которые формируют сгусток, закрывающий поврежденный сосуд.
Для их прикрепления к поврежденному участку и соединения между собой используется специальный белок – фактор Виллебранда.
Сложное органическое соединение протромбин, находящееся в плазме, подвергается расщеплению и превращается в тромбин. Он расщепляет плазменный белок фибриноген с образованием прочных фибриновых нитей, «прошивающих» тромб. Кровотечение прекращается.
В гемостазе также участвуют кальций и III V, VII, X, XI, XII, XIII факторы. Они особенно важны при ликвидации обширных сосудистых повреждений.
Кроме свертывающей, есть ещё противосвертывающая система, в которую входит несколько веществ, основным из которых является Антитромбин III. Их задача – разрушать сгустки, не допуская тромбозов.
При распаде тромба образуется белок D-димер. Нарушение функции противосвертывающей системы приводит к тромбообразованию.
Кровяные сгустки ухудшают кровоток, а их отрыв способствует закупорке основных сосудов (тромбоэмболии), приводящей к летальному исходу.
Определив состояние системы гемостаза, можно прогнозировать риск тромбозов и кровотечений.
Показания к проведению анализа на свертываемость крови
- Подготовка к оперативному вмешательству или травматичной процедуре. Обследование позволяет избежать осложнений.
- Подготовка к беременности. Нарушения свертываемости могут вызвать кровотечение при проведении процедуры ЭКО, в период вынашивания и родовой деятельности. При повышенной свертываемости возникает тромбоз сосудов плаценты, приводящий к преждевременным родам и выкидышам.
- Заболевания, сопровождающиеся образованием тромбов, – тромбозы, тромбофлебиты, осложненный варикоз.
- Гиперменорея – обильные месячные и дисфункциональные маточные кровотечения.
- Кровохарканье – кровяные следы в мокроте.
- Выкидыши и замирания беременности, вызванные образованием тромбов в сосудах плаценты.
- Внутренние и наружные кровотечения. Кровоточивость десен.
- Риск возникновения ишемического инсульта – закупорки сгустком просвета мозговых сосудов.
- Назначение противозачаточных препаратов, многие из которых противопоказаны при склонности к тромбообразованию. Таким женщинам лучше использовать другие методы контрацепции.
- Тяжелые патологии печени, почек, нарушающие образование тромбоцитов и влияющие на формирование сгустка.
Как подготовиться к анализу
Кровь для исследования берут строго натощак. Последний прием пищи должен быть не позже чем за 8 часов до взятия материала. Подготовиться к процедуре несложно:
- За 5 дней до исследования нужно исключить прием препаратов, влияющих на гемостаз.
- За сутки до процедуры нельзя употреблять жареную, жирную, тяжело усваиваемую пищу.
- Полчаса до взятия крови нельзя курить.
- Анализ не сдается на фоне тяжелых физических нагрузок и нервного напряжения. При возможности его лучше перенести на другое время.
Какие показатели определяет анализ
- Время свертываемости и длительность кровотечения (ВСК и ДК) – временной период, за который оно останавливается после прокола кожи.
- АЧТВ – активированное частичное тромбопластиновое и тромбиновое время. Анализ показывает период, в течение которого образуется сгусток после добавления специальных реактивов. С помощью такого исследования имитируется каскад процессов, возникающих при гемостазе.
- Протромбиновое время и протромбиновый индекс и МНО (международное нормализованное отношение) – определяемые и высчитываемые показатели адекватности свертываемости.
- Концентрацию фибриногена – белка, участвующего в формировании сгустка.
- Количество тромбоцитов – кровяных телец, формирующих тромб.
Понижение этих показателей грозит кровопотерей даже при небольших повреждениях, а повышение указывает на склонность к тромбозам.
Результаты сверх нормы наблюдаются при ДВС-синдроме – внутрисосудистом свертывании, сопровождающем травмы, обширные гнойные процессы, укусы змей, отравления, инфекции, лейкозы, тяжелую недостаточность внутренних органов.
Показатели противосвертывающей системы:
- Волчаночный коагулянт образуется при неправильной работе иммунной системы, которая начинает тормозить образование тромбов, приводя к кровотечениям. В норме этого вещества в анализе быть не должно.
- Антитромбин III – белок, замедляющий образование кровяного сгустка и тормозящий активность веществ-коагулянтов.
- D-димер – маркер тромбозов. Это вещество остаётся после разрушения фибриногена, находящегося в тромбе. Поскольку организм старается разрушить мешающие сгустки, рост концентрации D-димера свидетельствует об обширном тромбозе.
Уменьшение концентрации противосвертывающих компонентов приводит к образованию тромбов в ногах, сердечных сосудах, головном мозге, внутренних органах. У женщин такое нарушение приводит к выкидышам из-за тромбоза плацентарных сосудов. Это состояние часто бывает наследственным, но может вызываться и различными заболеваниями.
| Показатель свертываемости | Норма | Причины увеличения | Причины уменьшения |
| Время свертываемости | 5-7 мин | Пониженное количество тромбоцитов (тромбоцитопения), дефицит факторов свертывания, лейкоз, анемия, цирроз печени, недостаток витамина К | Заболевания сердца и сосудов, ревматизм, гормональные нарушения, инфекции, отравления, повышенная выработка тромбоцитов, болезнь Виллебранда, Кристмаса, гемофилия |
| Длительность кровотечения | 5 мин | ||
| Тромбоциты | 180-320 х 10^9/л | Злокачественные новообразования в костном мозге, травмы, туберкулез, удаленная селезенка, ревматизм, колиты, почечная недостаточность | Снижение активности костного мозга, тромбоцитопеническая пурпура – заболевания, сопровождающиеся кровоизлияниями на коже и слизистых |
| АЧТВ | 21,1-36,5 сек. | Болезнь Виллебранда, Кристмаса, гемофилия, тяжелые болезни печени, дефицит витамина К, ревматические поражения, имеющийся волчаночный коагулянт |
Наследственная склонность к тромбозам, использование противозачаточных таблеток |
| Протромбиновое время | 11-15 с. | Наследственные нарушения свертываемости, дефицит фибрина и фибриногена, болезни печени и почек, нехватка витамина К, повышение антитромбина III | Первый триместр беременности, опухоли, некоторые типы лейкозов |
| Протромбиновый индекс | 72-123 % | ||
| Тромбиновое время | 14-21 сек. | Цирроз, гепатит, болезни почек, увеличение концентрации эритроцитов | Превышение количества тромбоцитов |
| Фибриноген | 1,8-3,5 г/л | Злокачественные опухоли, инфаркт, ожоги, перенесенные операции, туберкулез, грипп, недостаточность щитовидной железы, перенесенный инсульт, болезни легких | Гепатит, миелолейкоз, цирроз печени, нехватка витаминов, отравления |
| Антитромбин III | 66-124 % | Болезни печени и почек, тромбозы, операции, кровопотери, онкологические патологии | |
| Волчаночный коагулянт | Отсутствует | Волчанка, ревматизм, нарушения работы иммунной системы, колит, злокачественные опухоли | |
| D-димер | 248 нг/мл | Ревматоидный артрит, сердечно-сосудистые заболевания, тромбозы, болезни печени | – |
Что делать, если анализ крови на свертываемость показал неблагоприятный результат
В этом случае нужно выяснить причину такого состояния. Для этого рекомендуется сдать:
- Общие анализы крови и мочи. Результаты этих несложных исследований показывают наличие патологий почек, печени, кроветворения.
- Биохимическое исследование – билирубин, АЛТ, АСТ, ГГТ, щелочная фосфатаза, креатинин, мочевая кислота, остаточный азот, мочевина, общий белок. Это исследование выявляет болезни печени и почек, влияющие на показатели коагулограммы.
- Кровь на микроэлементы – натрий, калий, кальций, хлор, недостаток которых влияет на коагулограмму.
- Кровь на онкомаркеры – ферритин, бета-2-микроглобулин, появляющиеся в крови при злокачественных заболеваниях кроветворной системы.
При ухудшении свертываемости крови или при тромбозах проводятся генетические обследования, выявляющие наследственные патологии, приводящие к ее изменению. По генам можно определить гемофилию, болезни Кристмаса, Виллебранда, дефицит факторов свертываемости V, VII, X, XI, XII, XIII. Также можно выявить генетическую предрасположенность к тромбозам (тромбофилию).
С результатами проведенной диагностики нужно обратиться к врачу. Опираясь на них, специалист назначит лечение основного заболевания, влияющего на свертываемость. При генетических и других неустранимых нарушениях прописываются препараты, прекращающие кровотечения и разжижающие тромбы.
Коагулограмма: все, что нужно знать о свертывании
Свертывание крови – процесс многоступенчатый, сложный и, при этом, чувствительный к действию целого ряда факторов. При этом симптомы «неполадок», как правило, долго не дают о себе знать. И анализ на свертываемость часто выявляет нарушения «случайно». Так кому же следует держать гемостаз «под присмотром»? И как понять показатели тем, кто уже проходит лечение?
Кому показан анализ
Исследование свертываемости крови, в первую очередь, показано тем, кто:
- страдает от заболеваний печени или перенес гепатит в прошлом (поскольку большинство факторов свертывания синтезируются именно в печени);
- страдает или имеет наследственную предрасположенность к тромбофлебиту и варикозу;
- страдает от сердечно-сосудистых или аутоиммунных заболеваний (высокий риск воспаления сосудов и, как следствие, усиление тромбообразования);
- принимает оральные контрацептивы или имеет избыток эстрадиола (женщины);
- невынашивание беременности в личной истории пациентки
Не стоит исключать из внимания и значимые факторы риска, как курение, лишний вес, малоподвижный образ жизни, возраст старше 40 лет, частые перелеты и другие.
Ну и, конечно же, такой анализ обязателен перед любой операцией, а также для тех, кто уже принимает «противосвертывающие» препараты.
О чем говорят показатели
Набор «стандартной» коагулограммы (50.0.H94.203) включает определение:
- АЧТВ,
- Протромбина (время, МНО),
- Тромбинового времени
- Фибриногена.
- Но что означают эти показатели?
- 1. АЧТВ, или активированное частичное тромбопластиновое время
- Оценивает скорость образования сгустка крови после добавления к плазме специальных реагентов, и измеряется в секундах.
- Иными словами, АЧТВ демонстрирует эффективность остановки кровотечения за счет плазменных факторов свертывания (как раз тех, что образуются в печени).
- При этом, удлинение (повышение) показателя сигнализирует о риске кровотечений, а укорочение – тромбоза.
- А особенно «актуален» анализ для людей, принимающих прямые антикоагулянты (гепарин и другие).
- 2. Протромбиновое время (ПВ)
- Это временной отрезок, за который происходит образование нитей фибрина, то есть собственно предшественника тромба.
- Показатель измеряется в % от нормы, которая составляет 70-120%.
- Чем выше этот показатель – тем выше скорость образования тромба, а значит – и риск тромбоза.
- А уменьшение ПВ – сигнал о склонности к кровотечениям.
- 3. МНО
- По сути – расчетный показатель, призванный стандартизировать данные о протромбиновом времени, полученные на разной аппаратуре.
Такие «сложности» стали необходимостью в связи с тем, что МНО – базовый анализ для подбора и коррекции «противосвертывающих» препаратов (как например, варфарин). А данные, полученные на разной аппаратуре (в разных лабораториях) зачастую не давали возможности сравнения между собой.
Поэтому Международный комитет по стандартизации в гематологии и Международный комитет по тромбозу и гемостазу в 1983 году ввели в использование МНО.
И сегодня, его уровень для здорового человека находится на уровне 0,8-1.2. А для принимающих непрямые антикоагулянты – 2,0-4,0.
При этом, повышение МНО ассоциировано с риском кровотечений, а снижение менее 0,5 – может говорить о тромбозе.
4. Фибриноген
В отличие от предыдущих показателей, это непосредственно субстрат для образования тромба. То есть не показатель скорости, а вещество. Поэтому и нормы для фибриногена измеряются в граммах на литр.
Повышение фибриногена наблюдается не только при повышенном тромбообразовании, но и при многих воспалительных процессах (как способ организма ограничить распространение «причинного фактора» и разрушенных тканей). А также у тех, кто принимает оральные контрацептивы или имеет повышенный уровень эстрогенов, беременных, людей с повышенным холестерином и курящих.
А снижение показателя может говорить не только о риске кровотечений, но и о заболеваниях печени.
Разумеется, перечисленные показатели являются только «базой» для оценки «здоровья» свертывающей системы крови. И в случае обнаружения значимых отклонений могут понадобиться дополнительные маркеры.
«Внутрисосудистое свертывание крови при COVID-19 определяет весь ход болезни»
Сегодня известно, что при COVID-19, в первую очередь, страдает свертывающая система крови. Вот почему у всех умерших от осложнений новой коронавирусной инфекции находят большое количество тромбов.
Как это объяснить? Почему это заметили не сразу? Каким образом и почему это происходит? Можно ли предотвратить развитие такого осложнения? Об этом – наш разговор с А.Д.
Макацария, академиком РАН, одним из крупнейших в мире специалистов по изучению нарушений свертываемости крови, создателем Школы клинической гемостазиологии, заведующим кафедрой Сеченовского университета.
Александр Давидович и его ученики активно сотрудничают с университетом Сорбонны, Венским, Римским, Миланским и Тель-Авивским университетами, Технион в Хайфе. Под его руководителем защищено 150 кандидатских и докторских диссертаций. Автор более 1200 научных трудов, в том числе 40 монографий.
– Александр Давидович, в последнее время во всем мире появляется всё больше сообщений о том, что при COVID-19 страдает свертывающая система крови. Так ли это, и если да, то чем вы объясняете этот феномен?
– Безусловно, это так. Более того, хочу сказать, что практически нет такой инфекции (вирусной или, тем более, бактериальной), которая бы не влияла на свертывание крови.
Доказательство тому – учение о сепсисе и септическом шоке как универсальной модели ДВС-синдрома – синдрома диссеминированного внутрисосудистого свертывания крови.
Степень тяжести тромботических нарушений зависит от особенностей возбудителя и организма-хозяина (иммунная система, система гемостаза, наличие сопутствующих заболеваний и т.д.).
– Но ведь не у всех пациентов развивается сепсис и септический шок?
– Конечно, не у всех. Поэтому очень актуальным и далеко не изученным в настоящее время является механизм патогенеза осложнений, вызванных коронавирусной инфекцией.
Во многом это обусловлено особенностями вируса, а также особенностями организма человека, начиная от количества и качества рецепторов, представленных у человека и их способностью связываться с этим вирусом.
Безусловно, на исходы заболевания огромное влияние оказывает коморбидность, то есть наличие сопутствующих хронических заболеваний у пациента.
– Почему, по вашему мнению, эта особенность течения болезни проявилась не сразу?
– Я считаю, что все это проявилось сразу, но не было адекватно оценено врачами изначально: еще не было такого количества вскрытий и широкого тестирования на гемостазиологические маркеры. Надо сказать, мы занимаемся изучением этой проблемы довольно давно, практически с самого начала эпидемии.
Еще в самом начале апреля мы опубликовали работу, основанную на первых наблюдениях наших китайских коллег. Работа называлась «COVID-19 и синдром диссеминированного внутрисосудистого свертывания крови».
Она имела чрезвычайно широкий резонанс, поскольку уже тогда врачи начали понимать роль свертывающей системы крови в инфекционном процессе.
– Каков механизм тромбообразования при covid-19 и отличается ли он от этого процесса при других патологиях?
– Это очень непростой вопрос. На сегодняшний день однозначно можно утверждать – при этом вирусе с самого начала имеет место активация гемостаза, внутрисосудистое свертывание крови и тромбообразование в сосудах мелкого калибра жизненно важных органов.
При этом повреждаются не только легкие, а блокада микроциркуляции и ее необратимый характер определяют исход заболевания. Позднее начало антикоагулянтной терапии является неблагоприятным фактором.
Причем этот процесс внутрисосудистого свертывания в капиллярах легкого играет важную роль в развитии острого респираторного дистресс-синдрома (ОРДС), о котором все говорят. Но далеко не все с самого начала уловили связь между внутрисосудистым свертыванием крови и ОРДС.
В западной литературе даже появился термин «легочная интраваскулярная коагуляция». Практически во всех случаях имеет место активация системного воспалительного ответа. Это общебиологическая реакция, которая особенно проявляется в ответ на инфекцию, вирусные возбудители. Международные организации признали, что коронавирусная инфекция – это сепсис.
С другой стороны, международная организация по тромбозу и гемостазу в абсолютном числе случаев признала наличие ДВС-синдрома у тяжелых больных с COVID-19 . Сочетание сепсиса и коагулопатии – это септический шок. Еще китайские коллеги указывали, что в 92% случаев больные умирают от септического шока.
Конечно, нельзя отрицать, что наряду с вирусом причиной септического шока может быть присоединение вторичной бактериальной инфекции.
У больных COVID-19 и нарушениями в системе гемостаза, как правило, имеет место гиперферритинемия, которая возникает при критических состояниях как реактант острой фазы воспаления и характеризуется цитокиновым штормом вследствие гиперактивации макрофагов и моноцитов.
Вследствие этого вырабатывается большое количество ферритина – сложного белкового комплекса, выполняющего роль основного внутриклеточного депо железа у человека и животных. В данном случае это всегда белок острой фазы, маркер тяжелого воспаления, а вовсе не показатель перегрузки железом, как можно подумать на первый взгляд.
Таким образом, цитокиновый и тромботический шторм усугубляют состояние больного и определяют степень тяжести. Но есть и особенности.
Возможно, при COVID-19 в первую очередь повреждается фибринолиз – часть системы гемостаза, которая обеспечивает процесс разрушения уже сформированных кровяных сгустков, тем самым, выполняя защитную функцию предотвращения закупорки кровеносных сосудов фибриновыми сгустками.
Отсюда синдром фибринирования при меньшей частоте геморрагических осложнений. И отсюда же открывается перспектива применения тромболитиков, о чем сейчас так много говорят и пишут. А впервые предложили такую схему наши американские коллеги.
– А ведь есть немало людей с нарушениями свертываемости крови. Сейчас, во время эпидемии, для них настали трудные времена.
– Это так.
В нашей популяции есть люди не только с явными, но и со скрытыми нарушениями гемостаза, предрасполагающими к тромбозам – генетические тромбофилии, антифосфолипидный синдром и ряд других заболеваний, сопровождающихся избыточной активацией системы гемостаза; а также люди с высокой готовностью к супервоспалительному ответу (врожденные факторы и ряд ревматологических и иммунных заболеваний). Им сейчас важно контролировать своё состояние, а врачам не забывать об этом.
И, наконец, COVID-19 – это тромбовоспаление. Это, по сути, вирус-опосредованная модель NET-оза, которая характеризует тесную взаимосвязь таких биологических процессов, как воспаление и тромбообразование.
Нейтрофилы и выделяемые ими внеклеточные ловушки нейтрофилов (NET) играют огромную роль в развитии так называемых иммунотромбозов.
Это одно из приоритетных научных направлений сегодня , которое мы сейчас вместе с учениками и в том числе зарубежными коллегами также разрабатываем.
Вообще надо сказать, что открытие NET расширило горизонты в понимании биологии нейтрофилов и роли этих клеток в организме. Использование организмом хозяина хроматина в сочетании с внутриклеточными белками в качестве естественного противомикробного агента имеет древнюю историю и меняет наше представление о хроматине как только о носителе генетической информации.
Благодаря избыточному и неконтролируемому формированию NET, нейтрофилы могут способствовать развитию патологического венозного и артериального тромбоза, или «иммунотромбоза», а также играют важную роль в процессах атеротромбоза и атеросклероза. Высвобождение NET является, как выяснилось, одной из причин тромбообразования при таких состояниях, как сепсис и рак.
Наличие NET при этих заболеваниях и состояниях дает возможность использовать их или отдельные компоненты в качестве потенциальных биомаркеров. NET и их компоненты могут быть привлекательны в качестве терапевтических мишеней. Дальнейшие исследования нейтрофилов и NET необходимы для разработки новых подходов к диагностике и лечению воспалительных и тромботических состояний.
– Размышляя о высокой летальности у пациентов, которым пришлось применить ИВЛ, вы констатируете, что мы, возможно, пошли не тем путем. А какой путь может оказаться более верным?
– Да, я имел в виду, что при оценке вентиляционно-перфузионных нарушений при COVID-19 превалируют перфузионные нарушения, нарушения микроциркуляции, а это значит, что главная терапевтическая мишень – восстановление нормальной перфузии тканей, то есть противотромботическая терапия, а возможно, даже и фибринолитическая. Механическая вентиляция не может решить вопрос перфузионных нарушений.
– Видите ли вы, что в связи с эпидемией стали более частыми проблемы тромбообразования в акушерско-гинекологической практике?
– Случилось так, что во многом и благодаря нашим стараниям (лекциям и публикациям), большинство акушеров сегодня осведомлены о том, что беременность – это состояние так называемой физиологической гиперкоагуляции, и этим пациенткам нередко назначаются антикоагулянты во время беременности. Тем не менее, требуются дальнейшие исследования для вынесения суждения о частоте тромбозов у беременных с COVID-19.
Вообще надо сказать, что большинство осложнений беременности либо обусловлены, либо сочетаются с высоким тромбогенным потенциалом.
Генетические факторы свертывания крови, особенно антифосфолипидный синдром, являются факторами риска огромного количества осложнений беременности – это и внутриутробные гибели плода, и неудачи ЭКО, и задержка внутриутробного развития плода, и преждевременная отслойка плаценты, что приводит к тяжелым тромбогеморрагическим осложнениям, это, наконец, тромбозы и тромбоэмболии. Поэтому, конечно, можно ожидать, что в условиях COVID-19 эти осложнения могут представлять собой еще большую опасность. Ведь вирус может быть фактором, активирующим факторы свертываемости крови. Конечно, тут нужны обобщающие исследования, но уже сейчас наши отдельные наблюдения говорят о том, что риск таких осложнений возрастает.
– Являются ли, на ваш взгляд, одним из проявлений этой проблемы случаи тяжелого течения covid-19 в педиатрии (состояния, похожие на синдром Кавасаки)?
– Глава ВОЗ Тедрос Аданом Гебрейесус призвал врачей всех стран обратить особое внимание на сообщения о том, что у некоторых детей, заразившихся коронавирусом, проявляются симптомы, схожие с еще одним заболеванием — синдромом Кавасаки (мультисистемным воспалительным синдромом). Действительно, в сообщениях из Европы и Северной Америки говорилось, что некоторое число детей поступало в отделения интенсивной терапии с мультисистемным воспалительным состоянием, с некоторыми симптомами, похожими на синдром Кавасаки и синдром токсического шока.
Синдром Кавасаки был впервые описан в 1967 году японским педиатром по имени Томисаку Кавасаки. Он обычно поражает детей до пяти лет.
При этом синдроме у пациента начинается воспаление кровеносных сосудов (васкулит) и лихорадка.
Болезнь Кавасаки имеет четко выраженный набор симптомов, включая постоянно высокую температуру, покраснение глаз и области вокруг рта, сыпь на теле и покраснение и отек ног и рук.
13 мая нынешнего года в авторитетном медицинском издании The Lancet было опубликовано исследование итальянских врачей, которые сообщили, что в провинции Бергамо, одной из наиболее пострадавших от эпидемии коронавируса, была зафиксирована вспышка синдрома Кавасаки или схожего с ним синдрома.
Важно, что в большинстве случаев дети также имели положительный результат теста на антитела к КОВИД-19, предполагая, что синдром последовал за вирусной инфекцией.
Болезнь Кавасаки имеет тенденцию проявляться в группах генетически похожих детей и может выглядеть немного по-разному в зависимости от генетики, лежащей в основе группы. Это говорит о том, что различные триггеры могут вызывать воспалительную реакцию у детей с определенной генетической предрасположенностью.
Вполне возможно, что атипичная пневмония SARS-COV-2, вызванная вирусом COVID-19, является одним из таких триггеров. Это важный вопрос, требующий пристального изучения.
– Александр Давидович, как вы думаете, почему у всех COVID-19 проявляется по-разному?
– Тут очень важна проблема факторов риска. Всё дело в том, что, помимо видимых болезней типа сахарного диабета или гипертонии, существуют болезни невидимые, о которых мы зачастую даже не подозреваем. В последние годы большое распространение получило учение о генетической тромбофилии.
Во всем мире это примерно до 20 процентов людей, которые являются носителями той или иной формы генетической тромбофилии. С этим можно жить сто лет, но если возникает инфекция, травма, делается операция – больной может погибнуть от тромбоэмболии, даже если операция выполнена на высочайшем техническом уровне.
Причиной тому – скрытая генетическая тромбофилия – мутация, которая делает её носителя подверженным высокому риску тромбообразования.
Одна из форм тромбофилии – так называемая гипергомоцистеинемия, которая может быть как приобретенной так и генетически обусловленной, также может быть важным фактором тромбозов, инфарктов, инсультов. А сейчас есть данные о том, что гипергомоцистеинемия усугубляется и при SARS-CoV2 инфекции.
Соответственно, в группу риска входят все те, у кого повышен уровень гомоцистеина в крови , но человек может не знать об этом. Поэтому мы сейчас начали масштабное исследование по выявлению этих групп риска, выделению различных форм тромбофилии у больных с COVID-19.
Наша цель – узнать, входят ли эти люди в группы риска по развитию тяжелых осложнений новой коронавирусной инфекции.
Высокая контагиозность вируса и большое количество заболевших поневоле «позволяет» вирусу выявить людей с изначальной явной или скрытой предрасположенностью к тромбозам.
Это пациенты не только с генетической тромбофилией или антифосфолипидным синдромом, но и с сахарным диабетом, ожирением, ревматическими болезнями и другими патологическими состояниями, ассоциированными с повышенным свертыванием и/или воспалением.
– Какие методы профилактики и лечения covid-19 вы считаете перспективными?
– Помимо уже названных, это противовирусная терапия, терапия специфическими иммуноглобулинами, противотромботическая терапия и лечение, направленное на снижение воспаления (так называемые антицитокиновые препараты).
Многое нам предстоит ещё понять об этом новом для нас заболевании, но постепенно мы движемся в сторону лучшего объяснения многих его механизмов.
Вы знаете, я всегда много работал, но, пожалуй, никогда ещё я не был так занят исследовательской и практической работой, как сейчас. Уверен, что она даст свои важные результаты.
Беседу вела Наталия Лескова.
Ссылка на публикацию: medbook.ru