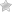Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми.
Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными.
Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное.
В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной.
В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов.
На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020.
Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций.
В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка.
Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами.
Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость.
На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.
Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия.
В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы.
У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
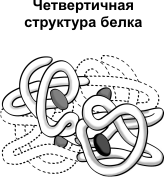
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям.
Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин.
Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Свойства белков
- Купить проверочные работы по биологии
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
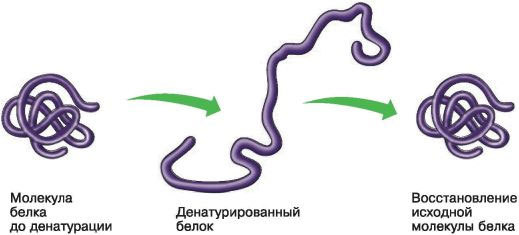
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные.
Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций.
Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией.
Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью.
Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов.
Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е.
в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром.
Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).
Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента.
При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента.
Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.
Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
- оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому — дегидрогеназа),
- трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому — трансаминаза),
- гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта — амилаза, липаза),
- лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S — декарбоксилаза),
- изомеразы (внутримолекулярная перестройка — изомераза),
- лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S — синтетаза).
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
- Перейти к лекции №2 «Строение и функции углеводов и липидов»
- Перейти к лекции №4 «Строение и функции нуклеиновых кислот АТФ»
- Смотреть оглавление (лекции №1-25)
Белки
Белки – наиболее важные органические соединения клетки. Их содержание колеблется от 50% до 80% в разных клетках организма.
Строение белков
В состав белков, кроме 4 основных химических элементов (углерод, кислорода, водород, азот), могут входит фосфор, сера, железо. Белки – сложные высокомолекулярные соединения, которые составлены из аминокислотных последовательностей.
Аминокислоты состоят из двух частей: аминогруппы -NH2 и карбоксильной группы -COOH.
Первая несет в себе основные свойства, а вторая – кислотные, что обуславливает активности и амфотерность этих соединений (Амфотерность – проявление кислотных или основных свойств в зависимости от реакции). Аминокислоты отличаются радикалами.
Строение аминокислоты
Аминокислоты ассоциируются с генетическим кодом, так как последовательности нуклеотидов кодируют триплеты нуклеотидов. Такие задачи изучаются в школе и встречаются в ЕГЭ. Всем, кто сталкивался с генетикой, хорошо знакома таблица аминокислот:
Таблица аминокислот
В один белок может входить много аминокислот. Они соединяются в цепь посредством образования пептидных связей: азот одной аминокислоты связывается с углеродом другой аминокислоты:
Строение белка. Зеленым цветом обозначена карбоксильная группа аминокислоты, голубым цветом — аминогруппа аминокислоты
В состав белка может входить даже несколько аминокислотных цепей.
Всего аминокислот насчитывается около 170, однако основное разнообразие задают 20 аминокислот, что связано с тем, что одна аминокислота может кодироваться различными последовательностями кодонов, или другими словами, аминокислота может кодироваться разными триплетами нуклеотидов. Это одно из свойств генетического кода (свойство избыточности).
Некоторые аминокислоты животный организм синтезирует самостоятельно, но, как можно догадаться, не все. Такие аминокислоты называются незаменимыми аминокислотами, их следует употреблять с пищей.
Например, лейцин используется не просто как биологическая добавка, что достаточно распространено среди фармакологических компаний, но и применяется при лечении заболеваний печени, а также анемии, она же малокровие.
Классификация белков
Протеины – белки, в состав которых входят только белковые молекулы.
Протеиды – белки, в состав которых, кроме белковых молекул, входят небелковые молекулы.
- Гликопротеиды (белок + углевод)
- Липопротеиды (белок + липид)
- Нуклеопротеиды (белок + нуклеиновые кислоты)
Для того чтобы не путаться в понятиях, нужно вспомнить, что принимают спортсмены для того, чтобы скорее нарастить мышечную массу, то есть протеиновые коктейли, батончики и т.д. Именно протеиновые, это слово на слуху, пусть теперь оно ассоциируется с этой классификацией.
Уровни организации белковой молекулы
Структура белка именуется просто по счету, в зависимости от сложности укладки.
Первичная структура белка представляет собой прямую цепь из аминокислот. Она является главной и определяющей свойства, форму и функции белка.
Вторичная структура белка – уже две цепи. Однако эти цепи не идут параллельно друг другу. Они скручены в спираль и связаны водородными связями, которые их удерживают за счет того, что их много. ДНК была обнаружена именно в форме двойной спирали. В этом виде она наиболее известна.
Третичная структура белка – глобула. Глобула означает шар, что и является описанием структуры белка. В этом случае прочность обусловлена тремя видами связей: водородными, ионными и дисульфидными.
Четвертичная структура белка – это как бы глобула из глобул. Она встречается не у всех белков. Белок крови гемоглобин состоит из 4х субъединиц четвертичной структуры.
Первичная структура белка — цепь Вторичная структура белка — спираль Четвертичная структура белка — объединение глобул
Денатурация – утрата белковой молекулой своей природной структуры. Это обратимый процесс, похожий на сохранение в игре. Если белок денатурировал, но его природная структура не нарушена, то он восстановится.
Причин разрушения белка может быть много: высокая температура, химические повреждения, радиация, обезвоживание и т.д. Так что когда мы варим яйца или мясо, то происходит денатурация белка. Как мы видим, к исходному состояния он уже не возвращается (не ренатурирует).
Денатурацию и ренатурацию просто запомнить по похожим словам: денатурация – деградация – разрушение; ренатурация – регенерация – восстановление.
Денатурация и ренатурация
Функции белков
1.Структурная функция
Белки входят в состав всего в клетке: мембраны и органоиды. Кроме того, есть белки, которые очень важно знать:
- Коллаген – входит в состав соединительной ткани. Коллаген можно запомнить по кремам, которые обещают продлить молодость и расправить морщины.
- Кератин – известен всем, кто когда-либо смотрел рекламу шампуня для волос. Кератин входит в структуру волос и прочих производных нашего и животного тела: шерсть, перья, ногти, когти, копыта, рога.
Строение и функции белков
Белки – полимеры, мономерами которых являются аминокислоты.
Среди органических веществ белки занимают первое место по количеству и по значению. В организме человека встречаются 5 млн разнообразных белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения они построены всего из 20 различных аминокислот.
Строение аминокислоты:
В левой части молекулы расположены группа H2N–, которая обладает свойствами основания; справа – группа –COOH – кислотная, характерная для всех органических кислот.
Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп.
Такие связи называются ковалентными, а в данном случае – пептидными связями:
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, – полипептидом.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация.
Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали (α-структура) или складчатого слоя – «гармошки» (β-структура). Это вторичная структура белка.
Но и ее часто недостаточно для приобретения характерной биологической активности.
Часто только молекула, обладающая третичной структурой, может выполнять роль катализатора или любую другую. Третичная структура образуется благодаря взаимодействию радикалов, в частности радикалов аминокислоты цистеина, которые содержат серу.
Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, соединяются, образуя так называемые дисульфидные, или S–S, связи.
Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы. Способ укладки полипептидных спиралей в глобуле называют третичной структурой белка.
Многие белки, обладающие третичной структурой, могут выполнять свою биологическую роль в клетке. Однако для осуществления некоторых функций организма требуется участие белков с еще более высоким уровнем организации.
Такую организацию называют четвертичной структурой. Присутствует не у всех белков. Она представляет собой функциональное объединение нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин.
Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий два компонента. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты.
Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо.
Строение белковой молекулы: А – первичная; Б – вторичная; В – третичная; Г – четвертичная структура
Строение молекулы гемоглобина
Гемоглобин – белок четвертичной структуры. В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем. Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Свойства белка
Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств:
- Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
- Белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
- Белки термолабильны, то есть проявляют свою активность в узких температурных рамках.
Денатурация и ренатурация белков
Денатурация – это утрата белковой молекулой своей структурной организации: четвертичной, третичной, вторичной, а при более жестких условиях – и первичной структуры. В результате денатурации белок теряет способность выполнять свою функцию.
Причинами денатурации могут быть высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей, тяжелых металлов и органических растворителей.
Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается структура белка и его функциональная активность. Такой процесс носит название ренатурации.
- Функции белков
- 1. Каталитическая (ферментативная) функция:
Многие белки являются ферментами. Ферменты — это биологические катализаторы, т. е. вещества, ускоряющие протекание химических реакций в живых организмах. Ферменты участвуют в процессах синтеза и расщепления различных веществ. Они обеспечивают фиксацию углерода в процессе фотосинтеза, расщепление питательных веществ в пищеварительном тракте и т. д.
2. Транспортная функция
Многие белки способны присоединять и переносить различные вещества. Гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из нее.
3. Защитная функция
Белки предохраняют организм от вторжения чужеродных организмов и от повреждений. Так, в ответ на проникновение чужеродных объектов (антигенов) определенные лейкоциты вырабатывают специфические белки — иммуноглобулины (антитела), участвующие в иммунном ответе организма. Белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
4. Двигательная (сократительная) функция
Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Так, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения.
5. Структурная (строительная, пластическая) функция
Белки входят в состав всех клеток и тканей живых организмов. Белки являются обязательным компонентом всех клеточных мембран и органоидов клетки. Из белков построены элементы цитоскелета, сократительные элементы мышечных волокон.
Преимущественно из белков состоят хрящи и сухожилия. В их состав входит белок коллаген. Важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт у животных является белок кератин.
В состав связок, стенок артерий и лёгких входит структурный белок эластин.
6. Сигнальная (рецепторная) функция
Некоторые белки клеточных мембран способны изменять свою структуру в ответ на действие внешних факторов. С помощью этих белков происходит прием сигналов из внешней среды и передача информации в клетку.
7. Регуляторная функция
Некоторые белки являются гормонами. Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
- 8. Запасающая (питательная) функция
- В семенах растений запасаются резервные белки, которые используются при прорастании зародышем.
- 9. Энергетическая функция
При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и жиров.
3.8.2. Белки
- Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
- В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
- Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
«Белки: химический состав, свойства и значение для человеческого организма»
- Доклад
- по биологии
- «Белки: химический состав, свойства
- и значение для человеческого организма»
- ученика 8 класса
- ГБОУ ООШ пос. Аверьяновский
- Григорьева Даниила
Руководитель: Величкина А.А.
Белки — основная структурная единица клеток. Это полимеры, мономерами которых являются аминокислоты. В состав белков входит 20 типов аминокислот.
В каждой из аминокислот содержится аминогруппа (-NH), карбоксильная группа (-СООН) и радикал (R). Строение радикалов отличается у различных аминокислот.
Соединение аминокислот в молекуле белка происходит благодаря образованию пептидной связи: аминогруппа одной аминокислоты соединяется с карбоксильной группой другой аминокислоты.
Для каждого белка характерна своя форма.
Белки, состоящее из нескольких аминокислот, называют пептидом. Выделяют первичную, вторичную, третичную и четвертичную структуры белков. Первичная структура белка определяется последовательностью аминокислот в полипептидной цепи. Порядок чередования аминокислот в данной белковой молекуле определяет её особые физико-химические , биологические свойства.
Вторичная структура представляет собой белковую нить, закрученную в виде спирали. Между карбоксильными группами на одном витке спирали и аминогруппами на другом витке возникают водородные связи, которые при их большом числе обеспечивают образование прочной структуры.
Третичная структура — это клубок, или глобула, в который свертывается спираль. Он образуется в результате взаимодействия различных остатков аминокислот
Четвертичная структура характерна для сложных белков. Несколько глобул объединены вместе и удерживаются вместе благодаря ионным, водородным и другим связям. Белок гемоглобин — состоит из четырех глобул, каждая из которых соединена с железосодержащим гемом.
Денатурация белков
Связи, поддерживающие пространственную структуру белка, довольно легко разрушаются. Мы с детства знаем, что при варке яиц прозрачный яичный белок превращается в упругую белую массу, а молоко при скисании загустевает. Происходит это из-за разрушения пространственной структуры белков альбумина в яичном белке и казеина.Такой процесс называется денатурацией.
Денатурация белка — разрушение сил (связей), стабилизирующих четвертичную, третичную и вторичную структуры, приводящее к дезориентации конфигурации белковой молекулы и сопровождаемое изменением растворимости, вязкости, химической активности, характера рассеивания рентгеновских лучей, снижением или полной потерей биологической функции.
В нашем примере в первом случае денатурацию вызывает нагревание, а во втором — значительное увеличение кислотности (в результате жизнедеятельности обитающих в молоке бактерий). При денатурации белок теряет способность выполнять присущие ему в организме функции.
Денатурированные белки легче усваиваются организмом, поэтому одной из целей термической обработки пищевых продуктов является денатурация белков.
Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители, алкалоиды) факторы, вызывающие денатурацию. Обратным процессом является ренатурация, то есть восстановление физико-химических и биологических свойств белка.
Иногда для этого достаточно удалить денатурирующий объект. Ренатурация невозможна, если затронута первичная структура. В природе почти ничего не происходит случайно. Если белок принял определённую форму в пространстве, это должно служить достижению какой-то цели.
Действительно, только белок с «правильной» пространственной структурой может обладать определёнными свойствами, т. е. выполнять те функции в организме, которые ему предписаны. А делает он это с помощью всё тех же R-групп аминокислот. Оказывается, боковые цепи не только поддерживают «правильную» форму молекулы белка в пространстве. R-группы могут связывать другие органические и неорганические молекулы, принимать участие в химических реакциях, выступая, например, в роли катализатора.
- Функции белков в организме
- Белки – это важные компоненты всех живых организмов, они участвуют в жизнедеятельности клетки.
- Каталитическая функция
Ферменты — это белки катализирующие разные реакции. Они способствуют расщеплению сложных молекул их образованию. Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. Пластическая функция Белки – незаменимый строительный материал. Одной из важнейших функций белковых молекул является пластическая. Все клеточные мембраны содержат белок, роль которого здесь разнообразна. Количество белка в мембранах составляет более половины массы.Белки входят в состав клеточных структур, являются структурными компонентами биологических мембран и многих внутриклеточных органоидов.
Энергетическая функция. Белки могут служить источ ником энергии для клетки. При недостатке в организме yглеводов или жиров окисляются молекулы аминокислот. При расщеплении 1 г белков высвобождается 17,6 кДж энергии.
Транспортная функция Имея различные функциональные группы и сложное строение макромолекулы, белки связывают и переносят с током крови многие соединения. Это гемоглобин, переносящий кислород из легких к клеткам. В мышцах эту функцию берет на себя еще один транспортный белок – миоглобин.
Запасающая функция
Эту функцию осуществляют так называемые резервные белки, являющиеся источниками питания для развития плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию.
Ряд других белков несомненно используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы обмена веществ.
К запасным белкам относят ферритин – железо, овальбумин – белок яйца, казеин – белок молока, зеин – белок семян кукурузы. В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока.
Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином.
Регуляторная функция
Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
Двигательная функция
Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных..
Энергетическая функция
При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы.
- Сигнальная функция
- В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку.
- Защитная функция
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
Значение белков в питании
Белок – необходимая составная часть продуктов питания. Проблема пищевого белка стоит очень остро. По данным Международной организации по продовольствию и сельскому хозяйству при ООН больше половины человечества не получает с пищей необходимого количества белка. Недостаток белка в пище вызывает тяжелое заболевание
Перечень продуктов, которые обеспечивают необходимое
количество белковых веществ.
| Наименование продукта | Количество | Белковые вещества |
| Ржаной хлеб | 250 | 12,8 |
| Белый хлеб | 200 | 14,3 |
| Крупа | 30 | 2,8 |
| Макароны | 10 | 0,9 |
| Мука пшеничная | 20 | 1,9 |
| Мясо | 150 | 22,7 |
| Рыба | 100 | 9,4 |
| Молоко | 400 | 14,2 |
| Творог, сыр | 70 | 11,2 |
| Сметана | 30 | 0,6 |
| Сливочное масло | 30 | 0,1 |
| Яйца | 1/2шт. | 2,6 |
| Картофель | 400 | 4,2 |
| Овощи | 300 | 3,5 |
| Фрукты, ягоды (свежие) | 200 | 0,8 |
| Итого: | 102,0 |
В процессе пищеварения белки подвергаются гидролизу до аминокислот, которые и всасываются в кровь. Пищевая ценность белка зависит от их аминокислотного состава, содержания в них так называемых незаменимых аминокислот, не синтезирующихся в организмах (для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин).
В питательном отношении растительные белки менее ценны, чем животные; они беднее лизином, метионином и триптофаном, труднее перевариваются. Один из путей решения проблемы – добавление в растительную пищу синтетических аминокислот. Наряду с этим выводят новые сорта растений, содержащие гены, ответственные за синтез недостающих аминокислот.
Перспективно использование для этого методов генетической инженерии. Чрезвычайно важное значение имеет широкое внедрение промышленного микробиологического синтеза, например, выращивание дрожжей на гидролизном этиловом спирте, природном газе или нефти. Получаемые при этом белково-витаминные концентраты (БВК) используют в качестве добавок к корму сельскохозяйственных животных.
Белок – неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Необходимость постоянного получения белковой пищи человеком вызвано наличием у белка определенных функций, которые необходимы живому организму для его развития, размножения и осуществления жизнедеятельности.
На долю белка приходится не менее 50 % сухой массы органических соединений животной клетки. Функционирование белка лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.
), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифических катализаторов биохимических реакций, являющихся белками. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки.
Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белков сократительной системы.
Важную группу составляют регуляторные белки, контролирующие биосинтез белка, и нуклеиновых кислот.
Белки играют важнейшую роль в жизнедеятельности всех организмов.
При пищеварении белковые молекулы перевариваются до аминокислот, которые, будучи хорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и клетки организма.
Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть — на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал.
Белки — важнейшие компоненты пищи человека и корма животных. Совокупность непрерывно протекающих химический превращений белков занимает ведущее место в обмене веществ организмов. Скорость обновления белков у живых организмов зависит от содержания белков в пище, а также его биологической ценности, которая определяется наличием и соотношением незаменимых аминокислот.
Белки растений беднее белков животного происхождения по содержанию незаменимых аминокислот, особенно лизина, метионина, триптофана.
Белки сои и картофеля по аминокислотному составу наиболее близки белкам животных. Отсутствие в корме незаменимых аминокислот приходит к тяжёлым нарушениям азотистого обмена.
Поэтому селекция зерновых культур направлена, в частности, и на повышение качества белкового состава зерна.

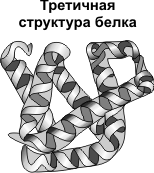

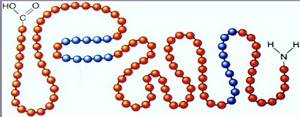 Первичная структура белка — цепь
Первичная структура белка — цепь 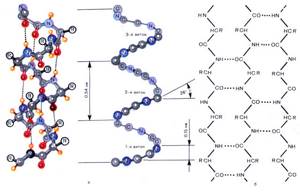 Вторичная структура белка — спираль
Вторичная структура белка — спираль 
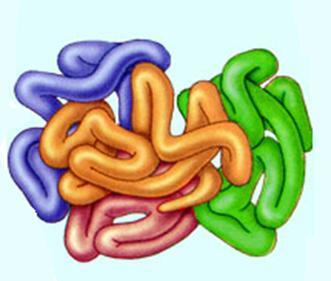 Четвертичная структура белка — объединение глобул
Четвертичная структура белка — объединение глобул