Начнем с определений
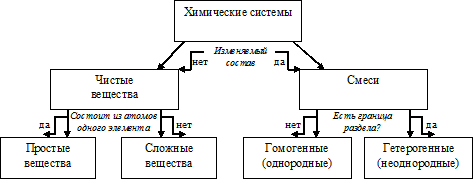
Чистое вещество состоит из молекул одного вида.
Чистые вещества могут быть элементного состава (т.е. состоять из элементов одного вида) — простые вещества:
- твердые вещества: железо, сера
- газы: H2, O2, N2 и т.д.
Чистые вещества — соединения — сложные вещества — состоят из молекул одного вида.
В природе не существует абсолютно чистых веществ. Например, особо чистый алюминий содержит 0,001% примесей.
Даже когда мы считаем воду чистой, то должны понимать, что там есть примеси. Даже дистиллированная вода не может считаться абсолютно чистым веществом — это тоже смесь, только примесей в ней намного меньше, чем в обычной воде.
Фильтрованная вода — тоже не чистое вещество, а смесь растворимых компонентов и воды, водопроводная — тем более!
Смеси — содержит молекулы нескольких видов.
Вещества, составляющие смесь, могут быть простыми и сложными.
Запомните: если вам дана задачи и в условии этой задачи дана смесь веществ, то вещества из этой смеси не реагируют друг с другом!
Однородные смеси (гомогенные)
«Гомо» — означает «одинаковый». Т.е. вещества в гомогенной смеси находятся в одинаковых агрегатных состояниях ( в одинаковых фазах):
- растворы;
- сплавы;
- газовые смеси
Воздух — пример однородной газовой смеси (если учитывать именно газовый состав, частички пыли и т.п. мы здесь не учитываем), молярная масса воздуха принята равной 29 гмоль.
Все растворы — однородные смеси растворимого вещества и растворителя.
Неоднородные смеси (гетерогенные)
Неоднородная смесь — это смесь, где вещества находятся в разных фазах.
- Суспензия: тв. фаза+ жидка фаза; существует только в «смешанном» виде. Если такую смесь оставить на время. то под действием силы тяжести твердые частички осядут. Примеры: зубная паста, гуашь, эмалевые краски и т.д.
- Эмульсия — смесь двух жидкостей разной плотности. Со временем четко разделяются на две фазы. Примеры: жидкость для снятия макияжа, масло в воде, молоко и т.д.
- Аэрозоль — смесь газа и жидкости. Самый известный пример — туман или лак для волос.
С определениями чистых веществ и смесей мы определились, теперь давайте разберем способы разделения смесей.
- Химический способ разделения смеси: в реакцию вводится вещество, реагирующее с одним компонентом и не взаимодействующее с другим. В идеале образующееся новое вещество может образовывать другую фазу, чтобы его можно было легко удалить (осадок или газ).
Физические способы:
Еще одно важное отличие чистых веществ от смесей — температуры плавления и кипения:
| Чистые вещества | Смеси |
| имеют четкие температуры плавления и кипения | плавятся и кипят в интервале температур |
- в ЕГЭ это вопрос А26
- в ГИА (ОГЭ) — А13
Обсуждение: “Чистые вещества и смеси”
(Правила комментирования)
Вещества и их свойства. Чистые вещества и смеси. Превращения веществ
В статье приводятся различия между физическим телом и веществом, дается понятие о чистых веществах и смесях, о свойствах веществ, о физических и химических явлениях. Приведены признаки и условия химических реакций, — их роль в жизни человека и в природе.
Вещество и его характеристики
Окружающий мир разнообразен, однако с научной точки зрения его богатство может быть выражено двумя понятиями: нас окружают тела и вещества. Необходимо различать их. Поскольку химия работает с веществом, нужно внимательно рассмотреть, какими основными признаками оно характеризуется, в каких явлениях участвует и каковы особенности этих явлений, называемых химическими.
Тело и вещество
Можно дать следующие определения этим основополагающим понятиям:
- Физическим телом называют материальный объект.
- Вещество представляет собой вид материи, то, из чего состоит любое физическое тело.
Тело имеет форму, отделено от окружающей среды границей и занимает в пространстве некоторый объем. Все тела состоят из веществ.
Вещество обладает важнейшей характеристикой – массой. От того, какое количество вещества заключено в теле, и от вида этого вещества зависит масса тела.
Стакан, растение, планета – это примеры тел. Вещество стакана – стекло. Растение состоит из множества веществ: углеводов, белков, воды и так далее. А число веществ, из которых состоит планета, например, Земля, исчисляется миллионами.
Из одного вещества могут быть образованы разные тела. Из меди можно изготовить как проволоку, так и монету, из пластика – посуду, мебель, трубы и другие предметы.
Если разделить физическое тело, образуются новые тела. Вещество при делении не изменяется, но имеет предел делимости – молекулу, мельчайшую структурную единицу.
Вещество в различных состояниях
В зависимости от условий, таких как температура и давление, составляющие вещество молекулы, располагаются и движутся по-разному. Вследствие этого вещество принимает различные агрегатные состояния – становится газообразным, жидким или твердым. Переход из одного состояния в другое осуществляется при определенном сочетании условий.
Например, при нормальном атмосферном давлении жидкая вода кипит и превращается в пар при 100 °C, а кристаллизуется в лед – при 0 °C. Обратные переходы – конденсация и плавление – происходят при той же комбинации условий.
Вещество, в любом агрегатном состоянии, образует тела. Так, пример жидкого тела – вода в сосуде. Такое тело принимает форму емкости, но при ее изменении сохраняет объем. Газ в баллоне тоже образует физическое тело. В отличие от жидких, газообразные тела заполняют емкость целиком.
Кроме трех основных агрегатных состояний, различают переходные – аморфное, жидкокристаллическое, – а также плазму.
Основные свойства вещества
Свойства любого вещества – это набор характеристик, дающих возможность отличить его от других веществ. Различают два вида свойств:
- Физические: цвет, вязкость, температура кипения и плавления, плотность, электропроводность, теплоемкость и другие. Эти свойства меняются при переходе в другое агрегатное состояние. Их можно наблюдать и измерять; при этом не требуется превращать одно вещество в другое.
- Химические свойства характеризуют особенности веществ относительно взаимодействий, при которых происходят изменения состава. Они показывают степень активности вещества и условия ее проявления. Переход между агрегатными состояниями не меняет химических свойств.
Чистые вещества и химические смеси
Наименьшей частицей вещества является молекула. Разные вещества состоят из отличающихся друг от друга молекул. Если вещество образовано одинаковыми молекулами, то оно называется чистым. Примеры чистых веществ – вода, сахар, полиэтилен.
В природе практически все вещества представлены в виде смесей – совокупностей, в которых присутствуют разные молекулы. Компоненты смеси не взаимодействуют химически и могут быть выделены физическими методами. Виды смесей, их примеры и способы разделения кратко можно представить в виде таблицы.
| Вид смеси | Свойства компонентов | Методы разделения |
Однородные, или гомогенные
|
Разбиты на мельчайшие частицы, неразличимые даже в микроскоп |
|
Неоднородные, или гетерогенные (механические смеси)
|
Частицы различимы в микроскоп или невооруженным глазом |
|
Соотношение компонентов в смеси может быть различным, в то время как состав чистых веществ неизменен, и их свойства остаются постоянными. Поскольку абсолютно чистых веществ не существует, принято считать чистым такое вещество, в котором примеси практически не оказывают влияния на свойства.
Явления, в которых участвует вещество
Физические явления
Если в ходе какого-либо процесса одни вещества не преобразуются в другие, то следует говорить о физическом явлении. При деформации, измельчении, растворении, изменении агрегатного состояния исходное вещество приобретает другие физические свойства. Однако никаких новых веществ из него не образуется.
Пример физического явления – протекание тока по медному проводу. Присутствует влияние на физическое состояние вещества — у проводника появляется магнитное поле, он нагревается. Но сам провод остается медным.
Химические явления
Процессы, сопровождающиеся превращением веществ, относятся к химическим явлениям, или реакциям, в результате которых происходит перестройка и образование новых молекул.
Так появляется ржавчина на железе, горят дрова в печи или пары бензина в двигателе автомобиля.
Электрический ток также может вызывать химические реакции, проходя через некоторые растворы, расплавы и через воду, разлагая ее на водород и кислород.
В химической реакции различают исходные вещества, которые вступают в нее – реагенты, – и образующиеся в итоге продукты реакции. К примеру, водород с кислородом, при определенных условиях могут выступить в качестве реагентов и образовать продукт – воду.
Признаки химических реакций
Определить, идет ли химическая реакция, можно по внешним признакам:
- изменение окраски веществ;
- выделение газа;
- выпадение или растворение осадка;
- появление запаха;
- выделение либо поглощение тепла;
- световое излучение.
Например, горение металла магния сопровождается большим тепловыделением и световой вспышкой, скисание молока – характерным запахом.
Условия, необходимые для химических реакций
Для начала реакции вещества должны соприкасаться. С целью увеличения площади контакта реагентов может потребоваться их измельчение и перемешивание, а также растворение. При соблюдении условия соприкосновения некоторые реакции начинаются самопроизвольно. В других случаях нужны дополнительные условия:
- нагревание;
- воздействие света;
- электрический ток;
- облучение;
- механическое воздействие;
- введение в реакционную смесь особых веществ – катализаторов.
Дальнейшее протекание реакции зависит от ее теплового эффекта. Дело в том, что при любом химическом процессе либо выделяется, либо поглощается энергия. По этому признаку различают два типа реакций:
- Экзотермические реакции идут с выделением тепловой (иногда и световой) энергии, которая поддерживает их течение. Таковы, например, все реакции горения: нагревание нужно только для того, чтобы инициировать их.
- Эндотермические реакции протекают с поглощением энергии. В качестве примера можно привести разложение сахара до сажи и воды. Эта реакция требует сильного нагревания и постоянного подвода тепла.
Роль химических явлений в жизни человека и в природе
Невозможно представить себе деятельность человека в любой области без химических процессов. Они применяются в энергетике и отоплении, транспорте, добыче и переработке сырья, в производстве материалов и всевозможных продуктов. Хотя человек научился использовать химические явления целенаправленно, их роль неизмеримо больше обслуживания нашей цивилизации.
Процессы жизнедеятельности, обеспечивающие существование живых организмов, связаны с превращениями вещества, а это означает, что они имеют химическую природу. В передаче генетической информации, дыхании, работе нервной и мышечной тканей, пищеварении, в фотосинтезе у растений – везде происходит выделение или поглощение химической энергии.
Химические реакции протекают повсюду – в океанах и атмосфере, в недрах Земли и в космосе. В тесном переплетении с физическими процессами они играют одну из ключевых ролей в жизни Вселенной.
Вопросы и задания
- В каком из высказываний речь идет о стекле как о веществе, а в каком – как о физическом теле?
- я заменил оконное стекло;
- графин сделан из стекла.
- Можно ли выделить из раствора сахар с помощью фильтрации? Почему?
- Какое из перечисленных явлений относится к химическим? Почему?
- высыхание лужи;
- осаждение бурых хлопьев из водного раствора марганцовки, стоявшего на свету;
- образование снежинки.
Ответы
- а) – тело; б) – вещество.
- Нет. Сахар в растворе разделен на мельчайшие частицы – молекулы, – которых не может задержать фильтр.
- б), так как появился осадок и произошло изменение цвета.
- Составьте из предложенного перечня два списка: а) чистые вещества и б) смеси.
- морская вода, полиэтилен, бензин, аэрозоль, медь, сахарный сироп, водород.
- Из предложенного списка выберите признаки химических реакций:
- образование осадка;
- плавление;
- кипение;
- поглощение тепла;
- выделение тепла;
- появление запаха;
- появление магнитного поля.
Ответы
- а) полиэтилен, медь, водород; б) морская вода, бензин, аэрозоль, сахарный сироп.
- а), г), д), е).
Занятие по химии на тему «Чистые вещества и смеси. Дисперсные системы»
Занятие по химии
Тема: «Чистые вещества и смеси. Дисперсные системы»
Составил: преподаватель УИФ ГБПОУ «ИЭК» Е.И.Панов
- Цели:
- Повторить в ходе выполнения эвристических заданий понятия «чистые вещества», «смеси», «дисперсная система», «классификация дисперсных систем»
- На конкретных примерах разобрать особенности строения и свойств различных дисперсных систем и их значение в практической деятельности человека
- Продолжить формирование ключевых компетенций у обучающихся, умений анализировать, сравнивать, сопоставлять, обобщать, делать выводы
- Тип занятия: обобщения и закрепления знаний
- Форма проведения занятия: лекция с элементами практической работы
- Технология, используемая на занятии: развития критического мышления
- Время проведения занятия: 90 минут
- Ход занятия
- 1. Стадия вызова
Учитель: Здравствуйте, ребята, мы продолжаем изучить науку химию и сегодня рассмотрим некоторые понятия. На доске приведены несколько карточек. Нам пока неизвестно, как они связаны между собой.
Рассмотрите их внимательно, постарайтесь определить каким образом их можно совместить, это поможет определить тему занятия.
Время на выполнения задания – 10 минут (Учащиеся выполняют задание, после один ученик по желанию составляет схему на доске).
Химические системы, чистые вещества, смеси, простые вещества, сложные вещества, гомогенные (однородные), гетерогенные (неоднородные).
У вас должна получиться следующая схема:
Итак, давайте попробуем сформулировать тему занятия (варианты ответов учащихся).
Тема занятия «Чистые вещества и смеси. Дисперсные системы».
2. Стадия осмысления
Чтобы дополнить составленную схему, вам необходимы дополнительные сведения. Чтобы их получить, предлагаю выполнить следующее задание. У вас на столах лежит текст для маркировки. Прочитайте текст, используя условные обозначения, сделайте пометки на полях. Время на выполнение задания 20 минут. После работы желающие выступят с результатами (ответы учащихся).
Я добавлю на доску дополнительные карточки. Расставьте их, пожалуйста. На это вам еще 10 минут.
- Изменяемый состав (да, нет)
- Состоит из атомов одного элемента (да, нет)
- Есть граница раздела? (да, нет)
Текст для маркировки «Чистые вещества и смеси»
Условные обозначения: «+» новая информация, «v» известная информация, «—» противоречивые данные (я ошибался), «?» недостаточно данных (не понятно)
| 1. Понятия «смесь», «компонент», «примесь» В повседневной жизни каждый из нас сталкивается со множеством смесей веществ, имеет дело не только с чистыми, но и загрязненными веществами. Важно уметь различать данные понятия и уметь определять по конкретным признакам, с чем имеешь дело: чистым или загрязненным веществом, индивидуальным веществом или смесью веществ. Ведь человек хочет употреблять только ту воду, которая не содержит вредных примесей. Дышать мы хотим воздухом, не загрязненным вредными для здоровья газами. В медицине и производстве лекарственных препаратов проблема получения и использования чистых веществ особенно актуальна. |
| Смесь – это то, что образуется при перемешивании двух и более различных по свойствам веществ. |
| Вещества, составляющие смесь, называют компонентами. Например, воздух – смесь газов: азота, кислорода, углекислого газа и других. |
| Если масса одного компонента в десятки раз меньше массы другого компонента смеси, то его называют примесью. Говорят, что вещество загрязнено. Например, воздух может быть загрязнен угарным газом, продуктом неполного сгорания органических соединений, в частности бензина. Кстати, бензин – это смесь органических веществ – углеводородов. |
| КЛАССИФИКАЦИЯ СМЕСЕЙ. Смеси отличаются друг от друга по внешнему виду. Например, соленая вода (смесь поваренной соли и воды) и смесь речного песка и воды. В первом случае нельзя увидеть границы раздела фаз твердое-жидкое. Такую смесь называют однородной (или гомогенной). Другими примерами однородных смесей являются уксус (смесь уксусной кислоты и воды), воздух, сахарный сироп. |
| Смесь речного песка и воды относят к неоднородным (или гетерогенным) смесям, т.к. состав такой смеси неодинаков в разных точках объема. Неоднородными являются смеси глины и воды, бензина и воды. |
| В основном, всё, что нас окружает, – это смеси веществ. Более того, веществ, абсолютно не содержащих примесей, не бывает. |
| Но принято говорить об относительной чистоте вещества, т.е. вещества имеют разную степень чистоты. |
| 2. Степень чистоты вещества Если примеси не обнаруживаются при использовании вещества в технических целях, то вещество называется технически чистым. Например, вещество, из которого делают фиолетовые чернила, может иметь в своем составе примеси. Но если эти примеси никак не влияют на качество чернил, то оно – технически чистое. |
| Если примеси не обнаруживаются с помощью химических реакций, то вещество относят к химически чистым. Например, это дистиллированная вода. |
| 3. Признаки индивидуальности вещества Чистое вещество иногда называют индивидуальным веществом, т.к. оно обладает строго определенными свойствами. Например, только дистиллированная вода имеет температуру плавления 0С, температуру кипения 100С и не имеет вкуса и запаха. |
| А изменяются ли свойства веществ в смеси? Чтобы ответить на этот вопрос, проведем простой опыт. Смешаем порошки серы и железа. Мы знаем, что железо притягивается магнитом, а сера – нет. Сохранило ли железо свое свойство после смешения с серой? Подействуем магнитом на смесь порошков серы и железа. Мы видим, что железо в смеси с серой не утратило способности к намагничиванию. |
- Теперь нам необходимо записать в тетрадь определения важных понятий по теме занятия.
- Смесь – система, состоящая из двух или более веществ (компонентов).
- Гомогенная однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно (между частями системы нет поверхностей раздела).
Гетерогенная неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам.
- Дисперсная фаза – совокупность мелких однородных твёрдых частиц, капелек жидкости или пузырьков газа, равномерно распределённых в окружающей (дисперсионной) среде.
- Дисперсионная среда – непрерывная фаза (тело), в объёме которой распределена другая (дисперсная) фаза в виде мелких твёрдых частиц, капелек жидкости или пузырьков газа.
- А сейчас немного отдохнем и проведем физминутку.
- Один хлопок – команда рукам (поднять, опустить)
- Два хлопка – команда ногам (встать, сесть).
В ходе выполнения следующего задания вам необходимо изучить примеры различных дисперсных систем и соотнести их с определенным типом. На доске представлены карточки. Вы выполняете задание в тетради, затем проверяем, что у вас получилось. Время – 20 минут.
- газ – жидкость
- газ – твердое вещество
- жидкость – газ
- жидкость – жидкость
- твердое вещество – твердое вещество
- твердое вещество – газ
- твердое вещество – жидкость
- жидкость – твердое вещество
- кислород
- соль
- уксус
- фосфор
- вода с сахаром
- смесь древесных и медных опилок
- сплав железа с углеродом
- растительное масло в воде медный купорос
- туман
- облака
- дым
- смог
- пыль в воздухе
- газированные напитки
- взбитые сливки
- зубная паста
- керамика
- пенопласт
- поролон
- пористый шоколад
- молоко
- майонез
- плазма крови
- цитоплазма
- морской ил
- строительные смеси
- желе желатин
- помада
- оксолиновая мазь
- горные породы
- цветные стекла
| Дисперсионная среда | Дисперсная фаза | Название системы | Пример |
| Газ | Жидкость | Аэрозоль | Туман, облака, карбюраторная смесь бензина с воздухом в двигателе автомобиля |
| Газ | Твердое вещество | Аэрозоль | Дым, смог, пыль в воздухе |
| Жидкость | Газ | Пена | Газированные напитки, взбитые сливки |
| Жидкость | Жидкость | Эмульсия | Молоко, майонез, жидкие среды организма (плазма крови, лимфа), жидкое содержимое клеток (цитоплазма, кариоплазма) |
| Жидкость | Твердое вещество | Золь, суспензия | Речной и морской ил, строительные растворы, пасты |
| Твердое вещество | Газ | Твердая пена | Керамика, пенопласта, полиуретан, поролон, пористый шоколад |
| Твердое вещество | Жидкость | Гель | Желе, желатин, косметические и медицинские средства (мази, тушь, помада) |
| Твердое вещество | Твердое вещество | Твердый золь | Горные породы, цветные стекла, некоторые сплавы |
3. Стадия рефлексии
Подведем итоги занятия. Для этого выполним небольшой тест. Я буду зачитывать вслух вопросы и варианты ответов, а вы отвечайте в своих тетрадях.
- 1. Укажите чистые вещества (2,3):
- 1) воздух; 2) азот
- 3) дистиллированная вода; 4) газированная вода
- 2. Чистые вещества, в отличие от смесей (1):
- 1) имеют постоянные физические и химические свойства
- 2) имеют только постоянные физические свойства
- 3) имеют постоянный количественный и качественный состав
- 4) имеют только постоянные химические свойства
- 3. Укажите неоднородные смеси веществ (1,3,4):
- 1) гранит; 2) раствор сахара в воде
- 3) морковный сок; 4) сметана
- 4. Укажите однородные смеси веществ (1,3):
- 1) раствор йода в спирте; 2) кефир
- 3) сплав золота и меди; 4) смесь муки и соли
- 5. Однородную смесь можно получить путем смешивания следующих веществ (2,3):
- 1) угля и песка; 2) углекислого газа и воздуха
- 3) азота и кислорода; 4) глины и воды
- Оценки за занятие вы поставите себе сами, используйте оценочные листы, подпишите их и сдайте мне.
- В завершении хочу показать вам небольшой видеоролик по теме занятия (просмотр видеоролика 6 минут).
В качестве домашнего задания вы выполните самостоятельную работу №3, которую найдете на нашем сайте в разделе «Студенту». Благодарю за плодотворную работу.
Список использованных источников
https://interneturok.ru/chemistry/8-klass/bpervonachalnye-himicheskie-predstavleniyab/chistye-veschestva-i-smesi
Габриелян О.С. Химия. учеб. для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г.Остроумов. – М.: Издательский центр «Академия», 2011. – С.58-64
https://ru.wikipedia.org/wiki/Дисперсные_системы
Тест: комплект видеоуроков «Химия. 9 класс» (проект для учителей Videouroki.net)
Чистые вещества и смеси
Смесь — это совокупность из двух или большего числа различных веществ, химически не соединённых между собой. Вещества в смеси могут находиться в любых соотношениях.
Пример. Атмосферный воздух представляет собой смесь газов, состоящую из кислорода, азота и других газов.
- Вещества, которые входят в состав смеси, называются компонентами смеси.
- Смеси делятся на однородные (гомогенные) и неоднородные (гетерогенные).
- Однородные (гомогенные) смеси — это смеси, в которых невооружённым глазом или даже с помощью микроскопа нельзя обнаружить компоненты, входящие в состав смеси.
Пример. Вода с растворённым в ней сахаром, воздух, большинство металлических сплавов — однородные смеси.
Однородные смеси иначе ещё называются растворами. Раствор — это однородная смесь, которая состоит из растворённого вещества и растворителя.
Физические свойства однородных смесей могут отличаться от свойств их компонентов.
Пример. Вода закипает при температуре 100 °C, а водный раствор соли — при более высокой температуре. Сплав олова со свинцом, используемый для паяния, плавится при более низкой температуре, чем чистые металлы.
Неоднородные (гетерогенные) смеси — это смеси, в которых невооружённым глазом или при помощи микроскопа можно увидеть компоненты, входящие в состав смеси.
Пример. Вода с песком, живые ткани, мутная вода, молоко — неоднородные смеси.
В неоднородных смесях физические свойства компонентов сохраняются.
Пример. Вода с песком закипает при температуре 100 °C.
Неоднородные смеси иначе ещё называются механическими смесями.
По агрегатному состоянию смеси можно разделить на три группы:
- газообразные (атмосферный воздух, природный и бытовой газы)
- жидкие (природная вода, молоко, нефть)
- твёрдые (природные минералы, горные породы)
Чистые вещества
Чистое вещество — это вещество, состоящее из частиц только одного вещества. Абсолютно чистые вещества получить невозможно, поэтому чистыми веществами условились называть такие вещества, в которых почти нет примесей. Примесь — это вещество, содержащееся в основном веществе в очень малом количестве.
Чистые вещества делятся на простые и сложные.
Простые вещества — это вещества, которые состоят из атомов одного химического элемента.
Пример. Кислород (O2), аргон (Ar), азот (N2) — простые вещества.
Сложные вещества — это вещества, которые состоят из атомов разных химических элементов.
Пример. Вода (H2O), углекислый газ (CO2), поваренная соль (NaCl) — сложные вещества.
Сложные вещества иначе ещё называются химическими соединениями.
Классификация веществ в виде схемы:
| Список литературы | | | contact@izamorfix.ru |
| 2018 − 2021 | © | izamorfix.ru |
Чистые вещества и смеси
Кроме разделения веществ на простые и сложные, их разделяют еще на чистые вещества и смеси. Чем чистое вещество отличается от смеси? Вещество, не содержащее примесей других веществ, называют чистым.
В нем содержатся только те частицы (молекулы, атомы), из которых оно образовалась, а других частиц быть не может.
Каким бы способом не получали чистое вещество, где бы в природе оно не находилось, состав его остается неизменным, постоянным.
Образование смеси (в) из чистых веществ (а) и (б)
Следует отметить, что абсолютно чистых веществ не существует. В каждом веществе есть определенное количество примесей. Например, вы знаете такое вещество, как поваренная соль. Это твердое вещество белого цвета, соленое на вкус, растворимое в воде.
Поваренная соль, которую мы покупаем в магазине, продается в пачках с надписями «Соль экстра» и «Каменная соль». Достаточно взглянуть на содержание каждой упаковки, чтобы сразу же сказать, что в каменной соли примесей больше.
И это действительно так, потому соль «Экстра» добывают дополнительной очисткой каменной соли от примесей других веществ. Однако полностью избавиться от других веществ все равно не удается.
В природе и быту значительно больше смесей, чем чистых веществ. Воздух, почва, гранит, морская вода — все это примеры природных смесей.
Как приготовить смесь
Смешиванием двух или более чистых веществ можно приготовить любую смесь. Рассмотрим пример приготовления смеси сахара и железных опилок. Сахар белого цвета и хорошо растворяется в воде. Железо в порошке темно-серого цвета, и, наверное, вы знаете, что оно имеет свойство притягиваться магнитом.
Смешаем по одной чайной ложке сахара и железных опилок. Отныне это будет смесь сахара и железа. В этой смеси есть молекулы сахара и атомы железа. Можно брать разные количества одного и другого веществ. В любом случае это будет смесь сахара и железа. В их состав будут входить одни и те же составляющие частицы обоих веществ, хотя и в разном количестве.
Сохраняют ли вещества свои свойства в составе смеси? Чтобы выяснить это, выполним опыт:
Смесь сахара и железных опилок высыплю на лист бумаги. Поднесем к смеси магнит. Железные опилки притянутся к магниту, а сахар останется на бумаге. И мы снова увидим его белый цвет.
Железо в составе смеси не потеряло своей свойства притягиваться к магниту. Сахар также сохранил свой белый цвет и твердое агрегатное состояние. Поместим сахар в сосуд с водой. Он довольно быстро растворится.
Значит и это свойство сахара сохранилась.
Так с помощью опыта мы выяснили, что в составе смеси сахар и железо сохранили свои свойства. Итак, в составе любых смесей вещества сохраняют свои свойства.
Содержание газов, входящих в состав воздуха, который человек вдыхает, и воздухе, который он выдыхает, существенно отличается. Мы дышим воздухом, в 100 л которого содержится примерно 21 л кислорода, 0,03 л углекислого газа и 79 л азота.
В выдыхаемом воздухе содержание газов другое: кислорода в нем уже около 16 л, углекислого газа — 5,03 л, азота — 79 л.
Как видим, содержание кислорода уменьшается, азота остается неизменным, а содержание углекислого газа увеличивается в 167 раз!
Увеличение содержания углекислого газа в воздухе отрицательно сказывается на самочувствии людей. Вот почему так важно проветривать помещение в школе и дома.
Использование смесей
Человек широко использует смеси в повседневной жизни. Так, для ремонта помещений готовят смесь цемента и песка. В производстве стекла используют смесь песка, соды и мела.
Таблетки представляют собой смесь вещества с лечебными свойствами и вещества-наполнителя. Напиток чай — это смесь, изготовленная из воды, сахара и веществ, которые поступили в воду из листьев чая в результате его заваривания.
Кстати, суп или компот — это также смеси.
Выполни дома опыт. Влияние температуры на растворимость воздуха в воде.
Для опыта тебе понадобятся стеклянная емкость и холодная вода. Набери холодной воды в небольшую емкость, например в стакан, и поставь ее на солнце или в теплое месте. Вы увидите, как через некоторое время на внутренней стенке емкости с водой появляются пузырьки, их достаточно много, и они густо расположены.
Идет выделение воздуха, который находился в смеси с водой, а при нагревании частично выделился.
В результате опыта удалось выяснить, что в холодной воде воздух хорошо растворяется. При нагревании температура воды повышается, а растворимость воздуха в ней уменьшается и он начинает выделяться в виде пузырьков.
Этот опыт доказывает, что температура влияет на растворимость воздуха в воде.
Заключение:
- Чистая вещество — вещество, которое не содержит примесей других веществ.
- Смеси состоят из нескольких чистых веществ, состав смесей может быть различным.
- В составе смеси вещества сохраняют свои свойства.
- Смеси могут быть в твердом, жидком и газообразные агрегатных состояниях.
- Существуют природные смеси и искусственные, которые создал человек.
Мир науки
Веществ в индивидуальном состоянии в природе практически не существует. Они смешанные друг с другом и образуют смеси и растворы. Смесями являются морская и газированная вода, молоко и сок, гранит и сталь.
Представление о смеси и чистые вещества имели еще древнегреческие ученые. Согласно этим представлениям, чистое вещество состоит из частиц одного вида, а смеси состоят из различных частиц. Итак, чистое вещество состоит из одинаковых молекул, а смеси – по разным.
Когда говорят о какое-либо вещество, всегда имеют в виду, что это вещество является чистой и состоит из частиц одного вида.
Но на практике идеально чистое вещество выделить из смеси невозможно, потому что среди частиц одного вещества обязательно случится несколько частиц другого вещества, то есть идеально чистых веществ не бывает.
Даже те вещества, которые называют чистыми, содержат посторонние частицы других веществ – примеси.
Обычно совершенно чистые вещества не нужны, однако иногда посторонние примеси могут мешать проведению опытов. Поэтому, когда речь идет о химические реактивы, обязательно указывают степень чистоты, такие отметки можно увидеть на банках с химическими реактивами.
Например, если на этикетке написано «техн» (техническая), то в таком веществе примесей содержится много, несколько процентов. Для опытов такие вещества обычно не используют, хотя в строительстве, на заводах такой степени чистоты обычно вполне достаточно. Степень чистоты «М» (чистая) или «ХЧ» (химически чистая) означает, что примесей очень мало, меньше одного процента.
«Чистые» реактивы можно использовать для производства лекарств, а «химически чистые» – для проведения научных опытов. Иногда нужны очень чистые вещества. Такие реактивы обозначают знаком «ОСЧ» (особо чистые). Они содержат, как правило, меньше 10-6 процента примесей.
Такие реактивы нужны для проведения очень точных экспериментов, а также при производстве микросхем для компьютеров. Очистка веществ – это довольно дорогая операция, поэтому чем чище вещество, тем она дороже.
Чаще всего по внешнему виду различить отдельные вещества в смеси не удается. Например, мы не видим, что воздух – это смесь нескольких газов.
По внешнему виду также нельзя определить, что молоко является смесью различных веществ, а большинство металлических предметов, которые нас окружают, сделаны из сплавов, а не из чистых металлов. Такие смеси называют однородными.
Частицы, образующие однородные смеси, настолько малы, что увидеть их невооруженным глазом невозможно.
Между тем в неоднородных смесях отдельные вещества можно увидеть невооруженным глазом.
В смеси все вещества (компоненты) сохраняют свои свойства. Например, если смешать железный порошок с поваренной солью и поднести к этой смеси магнит, то железо привлечен, а соль – нет. А если к этой же смеси добавить воду, то соль растворится, а железо не растворится. На этом принципе основано изготовление материалов, ведь большинство материалов являются смесями. Например,
чистое золото – это очень мягкий и податливый металл. Такая его свойство создает неудобства для изготовления большинства ювелирных изделий, поэтому в золото обязательно добавляют определенное количество серебра. Конечно, цвет такой смеси (сплава) немного отличается от цвета чистого золота, однако изделия из него значительно прочнее и не портятся от небольшого удара.
Существуют смеси неоднородны, отдельные ее компоненты видны невооруженным глазом, например крупинки песка в воде. Но большинство смесей, которые нас окружают, являются однородными и внешне почти не отличаются от чистых веществ. Чистая вещество всегда однородна, поэтому даже при значительном увеличении ее составляющие-кристаллики или крупинки имеют одинаковый вид.
Смеси можно отличить от чистых веществ с отличием физических свойств смеси от физических свойств отдельных компонентов. Несмотря на то, что каждое вещество придает смеси своих свойств, смесь никогда не имеет таких же свойств, как и чистые вещества отдельно.
Например, смесь олова и свинца (сплав) будет плавиться при температуре, ниже температуры плавления чистого олова или свинца. А чай или раствор сахара в воде будет кипеть при более высокой температуре, чем чистая вода.
В этом случае достаточно измерить температуру плавления или кипения смеси и сравнить результат с данными из справочника.
Чистые вещества плавятся и кипят при температуре, а смеси – в небольшом интервале температур. Если в стакан положить немного снега и опустить в него термометром температура снега не станет выше 0 ° С, пока он весь не растает.
Если же нагревать парафин, то он начинает плавиться при одной температуре, а когда становится совсем жидким, термометр будет показывать более высокую температуру.
Итак, парафин является смесью веществ, которые плавятся при различных температурах.