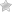1. Высокая удельная теплоемкость. Вода имеет высокую теплоемкость (в 10 раз большую, чем железо, и в 3300 раз большую, чем воздух). В сочетании с высокой теплопроводностью это делает водную среду достаточно комфортной для обитания живых организмов. (Вспомните из курса физики, что такое удельная теплоемкость. Среди физических характеристик среды, важных для существования в ней живых организмов, существенную роль играют также выталкивающая сила и вязкость, но их роль мы пока не рассматриваем.) Благодаря высокой теплоемкости и теплопроводности водная среда, в отличие от воздушной, менее подвержена перепадам температур (как суточным, так и сезонным), что облегчает адаптацию животных и растений к этому абиотическому фактору.
Вопрос 1. Каково значение этой физической характеристики для внутриклеточных процессов? (Для ответа на вопрос вспомните из курса химии понятия экзотермических и эндотермических реакций).
2. Несжимаемость. Вода практически несжимаема. Это позволяет многим беспозвоночным животным использовать заполненные водой полости тела в качестве внутренней опоры организма при передвижении (т.н. гидростатический скелет). Вопрос 2. Представители каких типов животных имеют гидростатический скелет?
3. Высокая температура кипения. Близкие по молекулярной массе вещества – метан и аммиак – при н.у. являются газами. Вода же – жидкость и остается ею при нагревании до 100оС. Аномально высокая температура кипения – результат того, что молекулы воды связаны между собою водородными связями. (Вспомните?) Именно на разрыв этих связей и тратится большое количество энергии. Для обитателей водной среды это также важно. Диапазон температур на планете (средняя + 7оС) практически не достигает верхней границы, точки кипения воды.
4. Высокая удельная теплота парообразования. Эта характеристика, также как и высокая температура кипения, обусловлена наличием водородных связей между молекулами воды. (Вспомните из курса физики, что такое удельная теплота парообразования.
Кстати, чтобы выпарить, к примеру, воду из чайника, тепла потребуется в 5,5 раза больше, чем для того, чтобы вскипятить его). Благодаря высокой теплоте парообразования живые организмы (не только животные, но и растения) получили возможность избавляться от избытков тепла в организме, испаряя воду с поверхности тела или его участков.
В отличие от других способов теплообмена живых организмов с окружающей средой (излучения, конвекции, теплопередачи) испарение позволяет охлаждать тело даже в том случае, когда температура окружающей среды выше, чем температура тела. Вопрос 3.
Какие жидкости испаряются с поверхности тела разных животных? Как называется процесс испарения воды с поверхности листьев растений и какую роль в жизни растений (кроме охлаждения поверхности листа) он играет?
| 5. Высокая сила поверхностного натяжения. Это свойство воды (по которому она уступает лишь ртути – см. таблицу) не только обуславливает способность воды подниматься по тонким капиллярам (что очень важно и для водного баланса почвы, и для транспорта по сосудам растений), но и возможность использования поверхностной пленки воды для передвижения. Такие животные образуют экологическую группу нейстон, которая делится на эпинейстон (те, кто передвигаются по поверхности пленки, как изображенная на фотографии водомерка), и гипонейстон – животных, прикрепляющихся к поверхностной пленке в воде (личинки некоторых мух и комаров). Статья Джирла Уолкера “Наблюдения за жизнью водомерок — насекомых, которые ходят (и даже бегают) по воде” (“В мире науки”, рубрика “Наука вокруг нас”, 1984, № 1, с. 92). | Рисунок – гиперссылка на видеофрагмент vodomer.avi (314 кб) |
| Интересный факт. Нормальная моча имеет поверхностное натяжение около 66*10−3 Н/м, но если в моче присутствует желчь (тест на желтуху), оно падает до 55. В тесте на желтуху (Hay's test) молотую серу насыпают на поверхность мочи. Она будет плавать на нормальной моче, но будет тонуть, если поверхностное натяжение снижено из-за желчи (солей желчных кислот). (отсюда) |
Неорганические соединения. Вода и ее свойства • биология-в.рф
Неорганические соединения. Вода и ее свойства
Вода
Среди всех веществ на первом месте по массе находится вода. Она составляет около 60-70 %, а в некоторых организмах-до 98 % содержимого. В эмали зубов — 10 %, в нервных клетках — до 85 %. Содержание воды зависит от возраста организма, его активности. Наиболее высокое содержание воды у эмбрионов (90-95 %).
У эмбриона человека в 1,5 месяца вода составляет 97,5 %, у восьмимесячного — 83 %, у новорожденного ребенка 74 %, у взрослого человека — в среднем 66 %. С возрастом содержание воды постепенно уменьшается.
Содержание воды в разных тканях различное и зависит от их метаболической активности: чем более интенсивные процессы обмена веществ, тем выше содержание воды.
Плотность
Теплоемкость воды и метана. Плотность и структура воды и льда. Гидратация: глицерин, катион и анион.
Вода имеет наибольшую плотность при 4 °С, а плотность льда меньше, чем плотность воды. Поэтому водоемы промерзают очень медленно, снаружи покрываясь льдом.
Вода почти не сжимается, что важно для придания формы и упругости клеткам, органам и тканям, обеспечивает тургорное давление, необходимое положение органов и частей организма в пространстве.
В сравнении с другими жидкостями вода характеризуется высокой температурой кипения, плавления, большей теплотой испарения (что обеспечивает защиту организма от перегревания).
Объясняется это тем, что молекулы воды более крепко связаны между собой, чем молекулы других растворителей.
Форма
Вода находится в двух формах — свободной и связанной (структурированной). Свободная вода составляет 95 % всей воды клетки. Используется преимущественно как растворитель и среда для коллоидной системы цитоплазмы. Связанная вода составляет 4-5% всей воды клетки.
Полярность
Молекулы воды полярны, состоят из двух атомов водорода, которые соединены с атомом кислорода ковалентной связью.
Они способны образовывать диполя (в области водорода преобладает положительный заряд, в области кислорода — отрицательный), которые формируют вокруг веществ (белков) водную оболочку и не позволяют им склеиваться. Вода неустойчиво соединена водородными и другими связями с белками.
Молекулы воды способны притягиваться одна к другой положительным и отрицательным зарядами, образуя водородные связи. Водородные связи слабее, чем ковалентные, в 15-20 раз. В жидком состоянии молекулы воды находятся в постоянном движении. Водородные связи при этом то создаются, то разрываются, создавая текучесть.
Растворитель
Вода хороший растворитель, лучше других жидкостей. В ней хорошо растворяется много минеральных и органических веществ, газов. Свойства растворителя обусловлены особенностями ее внутренней молекулярной структуры.
Вещество растворяется, если энергия притяжения молекул воды к молекулам любого вещества большая, чем энергия притяжения между молекулами воды. Вещества делятся, в зависимости от этого, на гидрофильные (от греч.
гидрос — вода и филио — люблю), которые хорошо растворяются, и гидрофобные (от греч. гидрос — вода, фобос — бояться), которые практически не растворимы. Гидрофильные вещества: большинство солей натрия, калия, некоторые белки, кислоты и т. п.
Гидрофобные — преимущественно неполярные вещества: жиры, жирообразные вещества, каучук, полисахариды и т. п. Они содержат неполярные группы, которые не взаимодействуют с молекулами воды.
Проникновение веществ в клетку и выведение из нее продуктов диссимиляции возможно преимущественно только в растворенном виде.
Вода является важной, основной средой, где протекают важные химические реакции.
Вода непосредственно принимает участие в биохимических реакциях — реакциях гидролиза (от греч. гидрос — вода и лизис — расщепление). Например, расщепление белков, углеводов и других веществ происходит вследствие взаимодействия их с водой с участием ферментов.
Вода образуется вследствие многих химических реакций обмена веществ.
Теплоемкость
Вода имеет большую теплоемкость (способность поглощать тепло при незначительных изменениях собственной температуры) и высокую теплопроводность. То есть она является идеальной жидкостью для поддержания теплового равновесия организма, защищает клетку от резких колебаний температуры.
Вода является источником ионов водорода и кислорода при фотосинтезе. Водород используется для восстановления продуктов ассимиляции углекислого газа.
Вода активно участвует в поддержке осмотического давления в клетке. Осмосом (от греч. осмос — давление) называется проникновение молекул растворителя через полупроницаемую мембрану в раствор большей концентрации растворенного вещества. То есть осмос — это односторонняя диффузия молекул воды в направлении растворенного вещества.
Переход молекул воды сквозь мембрану прекращается при выравнивании концентраций растворов или при повышении давления в более концентрированном растворе вследствие поступления в него воды. Давление, с которым вода проникает сквозь мембрану, называется осмотическим. Величина осмотического давления возрастает с увеличением концентрации раствора.
Осмотическое давление жидкостей организма человека и млекопитающих равняется давлению 0,85% раствора хлорида натрия. Это — изотонический раствор. Два раствора с одинаковым осмотическим давлением, независимо от химического состава растворенных веществ, называются изотоническими (от греч. изос — равный и тонус — сила, напряжение).
Более концентрированный раствор называется гипертоническим, менее — гипотоническим.
На явлениях осмоса основано движение воды проводящими тканями растений и напряженное состояние стенок растительных клеток — тургор (от лат. turgere — быть набухшим).
Вода, которая всасывается корневыми волосками растений, содержит мало растворенных веществ.
Вода проникает в клетки сквозь мембраны и создает в них повышенное давление, придает упругость (тургор) листьям, лепесткам цветов, стеблям травы.
Вода — это основное средство движения веществ в организме и клетке. Благодаря этому происходит обмен веществ между тканями.
Вода с растворенными в ней веществами изменяет температуру замерзания и кипения. Это свойство предотвращает замерзание клеток, организмов.
Молекулярный уровеньУровни организации живого
Гидрология
Вода — это простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом. По своей химической природе—это оксид (окись) водорода Н2О. В чистом виде вода — вещество бесцветное, не имеющее ни вкуса, ни запаха.
Молекула воды несимметрична: три ядра образуют равнобедренный треугольник с двумя ядрами водорода в основании и ядром кислорода в вершине.
Атом кислорода в молекуле воды присоединяет к себе два электрона, отнятых от атомов водорода, и тем самым приобретает отрицательный заряд.
Оба атома водорода, лишенные электронов, становятся положительно заряженными протонами. Молекула воды поэтому образует электрический диполь.
Полярное строение воды и возникающее в воде электрическое поле обусловливают большую диэлектрическую проницаемость воды— величину, показывающую, во сколько раз силы взаимодействия электрических зарядов уменьшаются в воде по сравнению с силами их взаимодействия в вакууме. Высокая диэлектрическая проницаемость воды предопределяет большую ее ионизирующую способность, т. е. способность расщеплять молекулы других веществ, что обусловливает сильное растворяющее действие воды.
Переход от полностью упорядоченной рыхлой молекулярной структуры, свойственной льду, к более плотной структуре, свойственной воде в жидком состоянии, не происходит мгновенно в процессе плавления льда, а продолжается и в жидкой воде.
При повышении температуры наряду с упомянутым уплотнением «упаковки» молекул происходит и свойственное всем веществам увеличение объема воды вследствие роста интенсивности теплового движения молекул.
В диапазоне повышения температуры от 0 до 4 °С преобладает процесс уплотнения воды, при температуре выше 4°С — тепловое расширение, поэтому вода обладает «аномальным» свойством — наибольшей плотностью не при температуре плавления, а при 4°С.
- Водород и кислород имеют несколько природных изотопов:
- 1Н – «обычный» водород),
- 2Н – «тяжелый» водород, или дейтерий),
- 3Н – радиоактивный «сверхтяжелый» водород, или тритий).
16О, 17О, 18О. Поэтому и сама вода имеет переменный изотопный состав.
Природная вода — это смесь вод разного изотопногосостава.
Наиболее распространена вода, состоящая из изотопов 1Н и 16О – «обычная» вода, доля других изотопных видов воды ничтожна — менее 0,27 %. Приведенные в дальнейшем сведения относятся только к «обычной» воде.
- Одна из главных причин, приводящих к различию изотопного состава природных вод,— процесс испарения.
- В результате испарения происходит некоторое обогащение воды более тяжелыми изотопами, а в результате конденсации — более легкими.
- Поэтому поверхностные воды, формирующиеся атмосферными осадками, содержат «тяжелого» водорода (3Н) и «тяжелого» кислорода (18О) меньше, чем океанические воды.
Воду с изотопным составом 'Н216О называют «обычной» водой и обозначают просто Н2О, остальные виды воды (кроме 3Н2О) называют «тяжелой» водой. Иногда «тяжелой» водой считают лишь дейтериевую воду 2Н2О (или О2О). Вода с изотопным составом 3Н2О (или Т2О) — так называемая «сверхтяжелая» вода. Ее на Земле находится всего 13—20 кг.
Удельная теплоемкость вещества — формулы, определение, обозначение
Эти два процесса знакомы каждому. Вот нам захотелось чайку, и мы ставим чайник, чтобы нагреть воду. Или ставим газировку в холодильник, чтобы охладить.
Логично предположить, что нагревание — это увеличение температуры, а охлаждение — ее уменьшение. Все, процесс понятен, едем дальше.
Но не тут-то было: температура меняется не «с потолка». Все завязано на таком понятии, как количество теплоты. При нагревании тело получает количество теплоты, а при нагревании — отдает.
- Количество теплоты — энергия, которую получает или теряет тело при теплопередаче.
Обнаружено новое непонятное слово — теплопередача. Минуточку, давайте закончим с количеством теплоты.
В процессах нагревания и охлаждения формулы для количества теплоты выглядят так:
|
В этих формулах фигурирует и изменение температуры, о котором мы сказали выше, и удельная теплоемкость, речь о которой пойдет дальше.
А вот теперь поговорим о видах теплопередачи.
Виды теплопередачи
- Теплопередача — это физический процесс передачи тепловой энергии от более нагретого тела к менее нагретому.
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Если мы греемся у камина, то получаем тепло конвекцией или излучением?????
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Удельная теплоемкость: понятие и формула для расчета
Формулы количества теплоты для нагревания и охлаждения мы уже разбирали, но давайте еще раз:
|
В этих формулах фигурирует такая величина, как удельная теплоемкость. По сути своей — это способность материала получать или отдавать тепло.
С точки зрения математики удельная теплоемкость вещества — это количество теплоты, которое надо к нему подвести, чтобы изменить температуру 1 кг вещества на 1 градус Цельсия:
|
Также ее можно рассчитать через теплоемкость вещества:
|
Величины теплоемкость и удельная теплоемкость означают практически одно и то же. Отличие в том, что теплоемкость — это способность всего вещества к передаче тепла. То есть формулу количества теплоты для нагревания тела можно записать в таком виде:
|
Таблица удельных теплоемкостей
Удельная теплоемкость — табличная величина. Часто ее указывают в условии задачи, но при отсутствии в условии — можно и нужно воспользоваться таблицей. Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
| Газы | C, Дж/(кг·К) |
| Азот N2 | 1051 |
| Аммиак NH3 | 2244 |
| Аргон Ar | 523 |
| Ацетилен C2H2 | 1683 |
| Водород H2 | 14270 |
| Воздух | 1005 |
| Гелий He | 5296 |
| Кислород O2 | 913 |
| Криптон Kr | 251 |
| Ксенон Xe | 159 |
| Метан CH4 | 2483 |
| Неон Ne | 1038 |
| Оксид азота N2O | 913 |
| Оксид азота NO | 976 |
| Оксид серы SO2 | 625 |
| Оксид углерода CO | 1043 |
| Пропан C3H8 | 1863 |
| Сероводород H2S | 1026 |
| Углекислый газ CO2 | 837 |
| Хлор Cl | 520 |
| Этан C2H6 | 1729 |
| Этилен C2H4 | 1528 |
| Металлы и сплавы | C, Дж/(кг·К) |
| Алюминий Al | 897 |
| Бронза алюминиевая | 420 |
| Бронза оловянистая | 380 |
| Вольфрам W | 134 |
| Дюралюминий | 880 |
| Железо Fe | 452 |
| Золото Au | 129 |
| Константан | 410 |
| Латунь | 378 |
| Манганин | 420 |
| Медь Cu | 383 |
| Никель Ni | 443 |
| Нихром | 460 |
| Олово Sn | 228 |
| Платина Pt | 133 |
| Ртуть Hg | 139 |
| Свинец Pb | 128 |
| Серебро Ag | 235 |
| Сталь стержневая арматурная | 482 |
| Сталь углеродистая | 468 |
| Сталь хромистая | 460 |
| Титан Ti | 520 |
| Уран U | 116 |
| Цинк Zn | 385 |
| Чугун белый | 540 |
| Чугун серый | 470 |
| Жидкости | Cp, Дж/(кг·К) |
| Азотная кислота (100%-ная) NH3 | 1720 |
| Бензин | 2090 |
| Вода | 4182 |
| Вода морская | 3936 |
| Водный раствор хлорида натрия (25%-ный) | 3300 |
| Глицерин | 2430 |
| Керосин | 2085…2220 |
| Масло подсолнечное рафинированное | 1775 |
| Молоко | 3906 |
| Нефть | 2100 |
| Парафин жидкий (при 50С) | 3000 |
| Серная кислота (100%-ная) H2SO4 | 1380 |
| Скипидар | 1800 |
| Спирт метиловый (метанол) | 2470 |
| Спирт этиловый (этанол) | 2470 |
| Топливо дизельное (солярка) | 2010 |
- Задача
- Какое твердое вещество массой 2 кг можно нагреть на 10 ˚C, сообщив ему количество теплоты, равное 7560 Дж?
- Решение:
- Используем формулу для нахождения удельной теплоемкости вещества:
- c= Q/m(tконечная – tначальная)
- Подставим значения из условия задачи:
- c= 7560/2*10 = 7560/20 = 378 Дж/кг*˚C
- Смотрим в таблицу удельных теплоемкостей для металлов и находим нужное значение.
| Металлы и сплавы | C, Дж/(кг·К) |
| Алюминий Al | 897 |
| Бронза алюминиевая | 420 |
| Бронза оловянистая | 380 |
| Вольфрам W | 134 |
| Дюралюминий | 880 |
| Железо Fe | 452 |
| Золото Au | 129 |
| Константан | 410 |
| Латунь | 378 |
| Манганин | 420 |
| Медь Cu | 383 |
| Никель Ni | 443 |
| Нихром | 460 |
| Олово Sn | 228 |
| Платина Pt | 133 |
| Ртуть Hg | 139 |
| Свинец Pb | 128 |
| Серебро Ag | 235 |
| Сталь стержневая арматурная | 482 |
| Сталь углеродистая | 468 |
| Сталь хромистая | 460 |
| Титан Ti | 520 |
| Уран U | 116 |
| Цинк Zn | 385 |
| Чугун белый | 540 |
| Чугун серый | 470 |
Ответ: латунь
Вода и ее роль в жизнедеятельности клетки — Гипермаркет знаний
Гипермаркет знаний>>Биология>>Биология 10 класс>> Вода и ее роль в жизнедеятельности клетки
Вода и ее роль в жизнедеятельности клетки
1. Какое строение имеет вода?2. Какое количество воды (в %) содержится в различных клетках?
3. Какова роль воды в живых организмах?
Роль воды в клетке.
Вода — одно из самых распространенных веществ на нашей планете. В клетке в количественном отношении она также занимает первое место среди других химических соединений. Чем выше интенсивность обмена веществ в той или иной клетке, тем больше в ней содержится воды.
Вода в клетке находится в двух формах: свободной и связанной. Свободная вода находится в межклеточных пространствах, сосудах, вакуолях, полостях органов. Она служит для переноса веществ из окружающей среды в клетку и наоборот. Связанная вода входит в состав некоторых клеточных структур, находясь между молекулами белка, мембранами, волокнами, и соединена с некоторыми белками.
Вода выполняет различные функции: сохранение объема, упругости клетки, растворение различных веществ. Кроме того, в живых системах большая часть химических реакций протекает в водных растворах.
Вода обладает рядом свойств, имеющих исключительно важное значение для живых организмов.
Свойства воды.
Уникальные свойства воды определяются структурой ее молекулы. Молекула воды состоит из атома О, связанного с двумя атомами Н полярными ковалентными связями.
Характерное расположение электронов в молекуле воды придает ей электрическую асимметрию.
Более электроотрицательный атом кислорода притягивает электроны атомов водорода сильнее, в результате общие пары электронов смещены в молекуле воды в его сторону.
Поэтому, хотя молекула воды в целом не заряжена, каждый из двух атомов водорода обладает частично положительным зарядом (обозначаемым δ+), а атом кислорода несет частично отрицательный заряд (δ-). Молекула воды поляризована и является диполем (имеет два полюса) (рис. 6).
Частично отрицательный заряд атома кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул. Таким образом, каждая молекула воды стремится связаться водородной связью с четырьмя соседними молекулами воды (рис. 7).
Вода является хорошим растворителем.
Благодаря полярности молекул и способности образовывать водородные связи вода легко растворяет ионные соединения (соли, кислоты, основания). Хорошо растворяются в воде и некоторые неионные, но полярные соединения, т. е.
в молекуле которых присутствуют заряженные (полярные) группы, например сахара, простые спирты, аминокислоты. Вещества, хорошо растворимые в воде, называются гидрофильными (от греч. hygros— влажный и philia — дружба, склонность).
Когда вещество переходит в раствор, его молекулы или ионы могут двигаться более свободно и, следовательно, реакционная способность вещества возрастает.
Это объясняет, почему вода является основной средой, в которой протекает большинство химических реакций, а все реакции гидролиза и многочисленные окислительно-восстановительные реакции идут при непосредственном участии воды.
Вещества, плохо или вовсе нерастворимые в воде, называются гидрофобными (от греч.phobos — страх). К ним относятся жиры, нуклеиновые кислоты, некоторые белки.
Такие вещества могут образовывать с водой поверхности раздела, на которых протекают многие химические реакции. Следовательно, тот факт, что вода не растворяет неполярные вещества, для живых организмов также очень важен.
К числу важных в физиологическом отношении свойств воды относится ее способность растворять газы (О2, С и др.).
Вода обладает высокой теплоемкостью, т. е. способностью поглощать тепловую энергию при минимальном повышении собственной температуры. Большая теплоемкость воды защищает ткани организма от быстрого и сильного повышения температуры. Многие организмы охлаждаются, испаряя воду (транспирация у растений, потоотделение у животных).
Вода обладает также высокой теплопроводностью, обеспечивая равномерное распределение тепла по всему организму. Следовательно, высокая удельная теплоемкость и высокая теплопроводность делают воду идеальной жидкостью для поддержания теплового равновесия клетки и организма.
Вода практически не сжимается, создавая тургорное давление, определяя объем и упругость клеток и тканей. Так, именно гидростатический скелет поддерживает форму у круглых червей, медуз и других организмов.
Вода характеризуется оптимальным для биологических систем значением силы поверхностного натяжения, которое возникает благодаря образованию водородных связей между молекулами воды и молекулами других веществ. Благодаря силе поверхностного натяжения происходит капиллярный кровоток, восходящий и нисходящий токи растворов в растениях.
Гидрофильные и гидрофобные вещества.
1. В чем особенность строения молекулы воды?2. Каково значение воды как растворителя?3. Что такое теплопроводность и теплоемкость воды?4. Почему считают, что вода является идеальной жидкостью для клетки?5. Какова роль воды в клетке?
6. Какие структурные и физико-химические свойства воды определяют ее биологическую роль в клетке?
Образование кристаллов льда в клетках может приводить к их повреждению и гибели. Известно, что растворы разных веществ замерзают при более низкой температуре, чем чистая вода.
Поэтому некоторые организмы накапливают в своих тканях вещества, предотвращающие замерзание и образование кристаллов льда. Так, лягушки способны оживать после вмерзания в лед.
Это обеспечивается повышенным содержанием в их клетках глюкозы и некоторых других веществ.
Каменский А. А., Криксунов Е. В., Пасечник В. В. Биология 10 классОтправлено читателями с интернет-сайта
Онлайн библиотека с учениками и книгами, плани-конспекти уроковс Биологии 10 класса, книги и учебники согласно календарного плана планирование Биологии 10 класса
Содержание урока
конспект уроку и опорный каркас презентация урока акселеративные методы и интерактивные технологии
закрытые упражнения (только для использования учителями)
оценивание Практика
задачи и упражнения,самопроверка практикумы, лабораторные, кейсы
уровень сложности задач: обычный, высокий, олимпиадный
домашнее задание Иллюстрации
иллюстрации: видеоклипы, аудио, фотографии, графики, таблицы, комикси, мультимедиа
рефераты
фишки для любознательных
шпаргалки
юмор, притчи, приколы, присказки, кроссворды, цитаты Дополнения
внешнее независимое тестирование (ВНТ)
учебники основные и дополнительные тематические праздники, слоганы статьи национальные особенности
словарь терминов прочие Только для учителей
идеальные уроки календарный план на год методические рекомендации программы
обсуждения
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь – Образовательный форум.
Как объясняют большую теплоемкость воды, большое поверхностное натяжение и свойство капиллярности?
Все эти особенности связаны с наличием водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода.
По причине этого, а также того, что ион водорода (протон) не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
Определенную роль играет протонное обменное взаимодействие между молекулами и внутри молекул воды. Каждая молекула воды может участвовать максимум в четырёх водородных связях: 2 атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда.
При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4 °С этот эффект становится слабее, чем тепловое расширение. При испарении рвутся все оставшиеся связи.
Разрыв связей требует много энергии, отсюда высокая температура и удельная теплота плавления и кипения и высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Какое значение имеют эти особенности воды в живой природе?
Высокая удельная теплоемкость
В сочетании с высокой теплопроводностью это делает водную среду достаточно комфортной для обитания живых организмов. Благодаря высокой теплоемкости и теплопроводности водная среда, в отличие от воздушной, менее подвержена перепадам температур (как суточным, так и сезонным), что облегчает адаптацию животных и растений к этому абиотическому фактору.
Большое поверхностное натяжение и когезия
Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь ее поверхности была минимальной (в идеале – форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды. Значительная когезия играет важную роль в живых клетках, а также при движении воды по сосудам в растениях.
Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: такие организмы образуют экологическую группу нейстон, которая делится на эпинейстон (те, кто передвигаются по поверхности пленки, как водомерка), и гипонейстон -организмов, прикрепляющихся к поверхностной пленке в воде (личинки некоторых мух и комаров).
Капиллярные явления играют существенную роль в водоснабжении растений, передвижении влаги в почвах и других пористых средах. Капиллярная пропитка различных материалов широко применяется в различных технологических процессах. Не меньшую роль капиллярные явления играют и при образовании новой фазы: капель жидкости при конденсации паров и пузырьков пара при кипении и кавитации.
Капиллярные явления играют большую роль в природе и технике.
Подъем питательного раствора по стеблю или стволу растения в значительной мере обусловлен явлением капиллярности: раствор поднимается по тонким капиллярным трубкам, образованным стенками растительных клеток.
По капиллярам почвы поднимается вода из глубинных в поверхностные слои почвы. Наоборот, разрыхляя поверхность почвы и создавая тем самым прерывистость в системе почвенных капилляров, можно задержать приток воды к зоне испарения и замедлить высушивание почвы.
Капиллярные явления играют существенную роль в водоснабжении растений и перемещении влаги в почве. В сухую погоду почва ссыхается, и в ней образуются трещины – капилляры.
По ним вода поднимается из-под земли вверх и испаряется. Поверхность земли из-за этого высыхает еще больше. Для сохранения влаги внутри земли верхний слой почвы разрыхляют.
При этом капилляры разрушаются и вода остается в почве.

 Рисунок – гиперссылка на видеофрагмент vodomer.avi (314 кб)
Рисунок – гиперссылка на видеофрагмент vodomer.avi (314 кб)