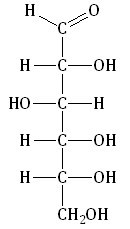
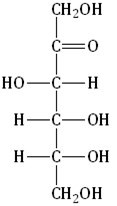
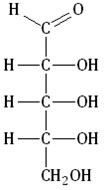
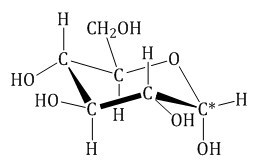
| Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3. |
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Классификация углеводов
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
Глюкоза С6Н12О6
|
Сахароза С12Н22О11
|
Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Химические свойства, общие для всех углеводов
1. Горение
Все углеводы горят до углекислого газа и воды.
| Например, при горении глюкозы образуются вода и углекислый газ |
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
C6H12O6 → 6C + 6H2O
Моносахариды
| Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 |
Фруктоза C6H12O6 |
Рибоза C5H10O5 |
| Структурная формула | |||
| Классификация |
|
|
|
Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
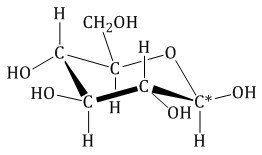
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
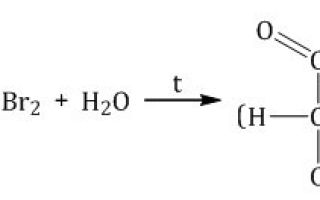
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
- Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
- C6H12O6 → 2C2H5OH + 2CO2
- Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
- Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
- Глюкоза способна образовывать простые и сложные эфиры.
- Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
- Например, α-D-глюкоза взаимодействует с метанолом.
- При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
| Простые эфиры глюкозы получили название гликозидов. |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |
Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
(C6H10O5)n + nH2O → nC6H12O6
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
6CH2=On → C6H12O6
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6H2O → C6H12O6 + 6O2
Фруктоза
| Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы). |
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
| Фруктоза | α-D-фруктоза | β-D-фруктоза |
- Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
- В свободном виде содержится в мёде и фруктах.
- Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
- При гидрировании фруктозы также получается сорбит.
Дисахариды
| Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). |
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
- Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
- В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
| Поэтому сахароза не вступает в реакции альдегидной группы – с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться. |
- Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
- C12H22O11 + H2O → C6H12O6 + C6H12O6
- глюкоза фруктоза
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
| Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов. |
При гидролизе мальтозы образуется глюкоза.
C12H22O11 + H2O → 2C6H12O6
Полисахариды
| Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. |
- Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
- Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
- Это объясняется особенностями их пространственного строения.
- Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Крахмал
- Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
- В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Запись полного гидролиза крахмала без промежуточных этапов:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
- Нитрование целлюлозы.
- Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
- Ацилирование целлюлозы.
- При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
- Получается ацетат целлюлозы – ацетатное волокно.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Лекция 14. Углеводы, моносахариды, полисахариды : Farmf | литература для фармацевтов
Углеводы, моносахариды, полисахариды. Углеводы широко распространены в животном и растительном мире, они играют исключительную роль во многих жизненных процессах. Углеводы составляют 80% сухой массы растений и 2% от сухой массы животных организмов.
Название углеводы этим природным веществам предложено в 1844 году К.Шмидтом, т.к. элементный состав известных тгда углеводов мог быть выражен как Сn(Н2О)m в настоящее время понятие углеводы стало гораздо шире.
Классификация углеводов.
Углеводы обычно подразделяют на моносахариды, олигосахариды и полисахариды.
Моносахариды (монозы) – вещества не способные подвергаться гидролизу.
Олигосахариды – вещества, образованные из нескольких остатков молекул моносахаридов (от 2-х до 8-10). Простейшими из них являются дисахариды.
Полисахариды являются высокомолекулярными соединениями, макромолекулы которых образованы из многих молекул моносахаридов.
- Моносахариды классифицируются по числу углеродных атомов в молекуле и присутствию альдегидной или кетонной группы:
Тетрозы
Пентозы
Гексозы - Моносахариды: альдозы, кетозы
- По строению моносахариды являются полигидроксиальдегидами или полигидроксикетонами:
- Моносахариды получают из полисахаридов путем гидролиза последних. Например, при гидролизе свекловичного или тростникового сахара получаются глюкоза и фруктоза:
Монозы хорошо растворимы вводе, большинство из них имеет сладкий вкус; растворы нейтральной реакцию При нагревании они окрашиваются в бурый цвет и обугливаются. Все природные моносахариды обладают оптической активностью.
Биологическое значение имеют главным образом сахара с 5 и 6 атомами углерода в молекуле (пентозы и гексозы). По своему строению они делятся на две большие группы: альдегидоспирты (альдозы) и кетоноспирты (кетозы):
В настоящее время считается установленным, что в растворе сахаров находятся как молекулы, строение которых приведено выше (цепная или открытая форма), так и молекулы, имеющие циклическое строение (циклическая полуацетальная форма):
Впервые циклическую форму для моноз предложил русский ученый А.А.Колли (1840-1916). Он выполнил также ряд других исследований по химии углеводов, имеющих большое значение.
Циклические формы углеводов можно рассматривать как производные двух типов циклических соединений: пирана (шестичленное кольцо) или фурана (пятичленное кольцо):
В фармации используют из моноз в основном глюкозу как лекарственное средство, фруктозу как заменитель сахара для больных сахарным диабетом; используются диозы: сахароза, лактоза, находят применение некоторые олигосахариды, напритмер в качестве инфузионных растворов, полисахариды – целлюлоза, крахмалы различного происхождения. В настоящее время широко применяются в качестве лекарственных средств производные углеводов: глюкозамин и его полимерное соединение хондроитин.
Glucosum-глюкоза.
Получение глюкозы. В свободном состоянии глюкоза находится в виноградном соке, в плодах и других органах различных растений. Основным источником получения глюкозы в промышленности является крахмал ( и реже – целлюлоза), которые гидролизуются в присутствии минеральных кислот:
Химическая структура. Глюкоза относится к альдозам, а по числу атомов углерода к гексозам:
Важная структурная особенность моносахаридов – это свойственная им изомерия. Глюкоза содержит несколько асимметричных атомов углерода, а именно – четыре, и следовательно для нее характерная пространственная изомерия (стереоизомерия).
При наличии в молекуле n асимметрических центров в общем случае число пространственных изомеров выражается формулой 2n.
24 = 16. Следовательно для глюкозы возможны 16 стереоизомеров, 8 пар антипод (энатиомеров).
Для обозначения пространственного строения каждого из стереоизомеров углеводы (как и другие оптически активные вещества) по предложению М.А.Розанова разделяют на два ряда: D-ряд и L-ряд. Простейшими представителями этих радов являются оптические антиподы глицеринового альдегида:
D-глицериновым альдегидом назвали правовращающий стереоизомер, который имеет у асимметричного атома углерода группу ОН справа при написании цепи альдегидной группой кверху. L-изомер имеет в этом случае группу ОН слева. Это типичный пример оптических изомеров.
Принято следующее условие: вещества, которые можно получить из D-глицеринового альдегида путем надстройки углеродной цепи со стороны альдегидной группы, относятся к D-ряду. Аналогичное положение применимо и к L-ряду.
Для углеводов характерно равновесное состояние между линейной и циклической структурой, причем в олигосахаридах они находятся в исключительно циклической форме:
Гидроксильная группа пятого атома углерода пространственно сближается с альдегидной группой с учетом величины валентного угла, это приводит к образованию внутреннего циклического полуацеталя. Циклизация приводит к образованию устойчивого шестичленного кольца, которое называется пиранозным.
Полуацетальный гидроксил, в свою очередь, обуславливает возможность:
1. Образовывать полные ацетали с другими сахарами и соединениями, содержащими NН2– и ОН-.
2. Образовывать полимерные структуры.
При образовании циклического полуацеталя углеродный атом карбонильной группы превращается в асимметрический. У этого вновь образованного асимметрического атома углерода атом водорода и гидроксильная группа могут располагаться двояким образом: Н-слева, ОН-справа и, наоборот, Н-справа, ОН-слева.
Такие изомеры, отличающиеся расположением полуацетального гидроксила, называются аномерами.
Чтобы различить аномеры, применяют условные обозначения: α- и β-; α-Аномер имеет полуацетальный гидроксил с той же стороны, где расположена группа ОН, указывающая принадлежность моносахарида к D- или L-ряду; β-аномер – наоборот.
Фармакопейным препаратом глюкозы является α- D-глюкоза:
Кристаллизационная вода глюкозы составляет 10% ее молярной массы.
Свойства. Белый мелкокристаллический порошок без запаха, сладкого вкуса. Легко растворим в воде, трудно в спирте, практически нерастворим в эфире.
Подлинность.
1. Органолептическое определение (сладкий вкус).
2. Взаимодействие с реактивом Феллинга( образование осадка закиси меди), Несслера( образование осадка ртути), реакция серебряного зеркала.
3. При нагревании с тимолом и концентрированной серной кислотой образуется темно-красное окрашивание. За счет дегидратации сахара образуется соответствующее фурфурольное производное, реагирующее с тимолом с образованием ауринового красителя:
4. При нагревании с резорцином и разбавленной соляной кислотой образуется розовое окрашивание.
5. Образование азазонов с фенилгидразином (кристаллический осадок желтого цвета):
Чистота. Глюкоза имеет удельное вращение, является правовращающей в ФС допускается интервал удельного вращения, указывается растворитель, концентрация раствора). Прозрачность, цветность, кислотность, общедопустимые хлориды, сульфаты, кальций. Недопустимые примеси: барий, декстран.
Определение величины удельного вращения [α]D20. Присутствие нескольких асимметрических центров в молекуле глюкозы обуславливает оптическую активность с сильно выраженным вращением плоскости поляризованного света.
Измерив угол, на который происходит вращение поляризованного света можно рассчитать удельное вращение. В свежеприготовленных растворах глюкозы происходит явление так называемой муторотации, которое представляет собой изменение величины вращения, достигающее через определенное время постоянной величины.
Муторотацию можно объяснить тем, что при растворении глюкозы, которая в кристаллическом состоянии находится в одной циклической форме, образуется ее альдегидная форма, через которую получаются аномерные циклические формы глюкозы: α- и β- формы, отличающиеся расположением заместителей у первого углеродного атома, в связи с чем они имеют различные величины вращения. Удельное вращение – это константа оптически активного вещества. Удельное вращение определяют расчетным путем как угол поворота плоскости поляризованного монохроматического света на пути длиной 1 дм в среде, содержащей оптически активное вещество, при условном приведении концентрации этого вещества к значению, равному 1г/мл.
Величину удельного вращения рассчитывают:
[α] = (α·100) / (l·c) (для растворов веществ)
Явление муторотации можно ускорить добавлением к раствору глюкозы аммиака.
Количественное определение. Количественное определение действующей фармакопейной статьей не предусматривается. В инъекционных формах используют рефрактометрию. Среди нефармакопейных методов, используемых для количественного определения глюкозы следует отметить:
1. Йодометрический метод способом обратного титрования, т.е. титрование избытка йода после окисления. Метод Вильштеттера. В щелочной или карбонатной среде с избыткой йода окисляется до кислоты (глюконовой). Йод оттитровывают тиосульфатом натрия.
2. Йодометрический после окисления реактивов Несслера.
3. Перманганатометрический (Метод Бертрана). Способ прямым титрованием. Метод основан на избирательном окислении альдегидной группы реактивом Феллинга с последующим прибавлением к раствору соли трехвалентного железа, которое в свою очередь оттитровывается раствором перманганата калия.
Фактор эквивалентности =1/2.
4. Рефрактометричексий метод. Исходя из коэффициента преломления раствора глюкозы.
5. Поляриметрический метод.
с =(α·100) / ([α]D20·l)
Применение. Глюкозу используют как источник легко усваиваемых организмов углеводов. Используют в виде растворов для внутривенного введения: 5%; 10%; 20%; и 40%. В форме таблеток 0,5 г и 1,0 г., а также в сочетании с витаминами и другими веществами.
Хранение. В хорошо укупоренной таре в сухом месте.
Стабилизация растворов глюкозы.
Инъекционные растворы глюкозы широко применяются и их часто готовят в аптеках. При выборе стабилизатора для раствора глюкозы необходимо учитывать полифункциональный характер этого вещества. Глюкоза неустойчива в щелочной среде, под влиянием кислорода образуются оксикислоты: гликолевая, левулиновая, муравьиная и оксиметилфурфурол.
Для предотвращения этого процесса растворы глюкозы стабилизируют 0,1 моль/л раствором НС1 до рН 3,0-4,0. Доказано, что при рН 3,0 происходит минимальное образование 5-оксиметилфурфурола, обладающего нефрогепатотоксическим действием.
Глюкоза неустойчива и в кислой среде – образуется D-глюконовая кислота и ее лактоны, в результате их окисления, особенно в процессе стерилизации, образуется 5-окситметилфур-фурол, вызывая пожелтение раствора.
- Растворы глюкозы в ГЛФ по ГФ Х1 стабилизируются добавлением 0,2 г NaCl на 1 л раствора и 0,1 моль/л раствором НСl до рН 3,0-4,0.
- В настоящее время считают, что NaCl в сочетании с НСl создают буферную систему стабилизирующую глюкозу в нейтральных и кислых средах. В условиях аптеки стабилизатор готовят по следующей прописи:
- NaCl – 5,2 г.
Кислоты соляной разведенной 4,4 мл - Воды для инъекций до 1 л.
- При изготовлении растворов глюкозы, независимо от ее концентрации, добавляют 5% этого стабилизатора.
Олигосахариды. Saccharum-сахар.
- Получение сахара из сахарной свеклы или сахарного тростника. Является дисахаридом, состоит из двух моносахаридов: D-(+)-глюкозы и D-(-)-фруктозы:
- α-D-глюкопиранозидо-β-D-фруктофуранозид.
Описание. Белые твердые куски мелкокристаллического строения, без запаха, сладкого вкуса. Очень легко растворим в воде.
Относится к невосстанавливающим сахарам, т.к. отсутствует полуацетальная гидроксигруппа, не дает реакции с раствором Феллинга и способны только к реакциям образования простых и сложных эфиров. Препарат легко гидролизуется в присутствии даже слабых кислот.
Подлинность. Препарат смешивают с раствором Со(NО3)2 и раствором NаОН, появившееся фиолетовое окрашивание. С резорцином и разбавленной соляной кислотой – красное окрашивание.
Удельное вращение от +66,5 до + 66,8º (10 водный раствор). Метод количественного определения – поляриметрический.
Применение. В качестве наполнителя в таблетках и порошках, на ее основе готовят сиропы, используемые как лекарственные формы, так и для коррекции ГЛФ.
Лактоза. Saccharum lactis.
4-(β-D-галактопиранозидо)- D-глюкопираноза.
Описание. Белые кристаллы или белый кристалличексий порошок, без запаха, сладкого вкуса. Легко растворим в воде, почти нерастворим в эфире и хлороформе.
Подлинность.
1. С реактивом Феллинга желтый осадок, переходящий в буровато-красный.
2. С резорцином и соляной кислотой при повышенной температуре – желтое окрашивание.
3. Удельное вращение от +52 до +53,2 (5% водный раствор).
Количественное определение.
1. Йодометрический;
2. Поляриметрический.
Применяется в качестве наполнителя в ГЛФ.
Полисахариды.Amilum-крахмал.
Получают крахмал из зерновых культур и картофеля. Он представляет собой смесь полисахаридов с общей формулой (С6Н10О5)х. Молекула крахмала включает остатки α-D-глюкопиранозы, отличающиеся друг от друга степенью полимеризации и характером связей.
Полисахариды, входящие в состав крахмала, можно разделить на две фракции: амилозу и амилопектин. Амилоза имеет в основном линейное ст роение с мольной массой 30000-160000.
Молекула ее построена из α-D-глюкопиранозных звеньев, но соединенных в положении 1→4:
Амилопектин – полисахарид разветвленного строения. Связи в положении 1-4 и 1-6. Мольная масса от 100000 до 1000000.
Производные углеводов. Глюкозамин. Представляет собой аминопроизводное глюкозы. Природным источником служит панцирь краба, креветки и другие хитинсодержащие препараты. Получают кислым гидролизом олигосахарида – хитозана:
2-амино-2-дезокси-β-D-глюкопираноза.
Применяют как противовоспалительное средство и структурный фрагмент хрящевой ткани для ее репарации. Входит в состав многих лекарственных форм и применяется самостоятельно в виде гидрохлорида.
Хондроитин. Олигоаминосахарид, представляющий собой фрагменты хрящевой ткани. Используется в качестве лекарственного средства в виде таблеток и мазей.
Биология. 11 класс
Углеводы — органические соединения, состав которых, как правило, можно выразить формулой Cn(H2O)m, где n и m равны трем и более. Таким образом, соотношение атомов водорода и кислорода в молекулах большинства углеводов такое же, как и в воде (2 : 1), что и отражено в названии этих веществ. Однако известны углеводы, состав которых не соответствует приведенной формуле.
*Термин «углеводы» ввел российский химик К. Г. Шмидт в середине XIX в., когда считалось, что все эти вещества имеют общую формулу Cn(H2O)m. Например, состав глюкозы (С6Н12О6) можно записать в виде С6(Н2О)6, сахарозы (С12Н22О11) — в виде С12(Н2О)11 и т. д.
Впоследствии выяснилось, что в молекулах некоторых соединений, принадлежащих по своим свойствам к углеводам, пропорция атомов водорода и кислорода не такая, как в молекуле воды. Более того, существуют углеводы, в состав которых входят атомы азота, фосфора или серы. В 1927 г.
Международная комиссия по реформе химической номенклатуры выдвинула предложение заменить название «углеводы» на «глициды». Однако к тому времени термин «углеводы» уже стал общеупотребимым и новое название не прижилось.*
Основные группы углеводов. Самыми простыми по структуре углеводами являются моносахариды. Все они представляют собой низкомолекулярные соединения, которые хорошо растворяются в воде и обладают сладким вкусом. Количество атомов углерода в молекулах моносахаридов варьирует от 3 до 9.
Наиболее распространены в природе пятиуглеродные моносахариды (С5) — пентозы и шестиуглеродные (С6) — гексозы. *Из курса химии вы знаете, что в растворе молекулы моносахаридов обычно существуют не в линейной форме, а в циклической.
При замыкании в цикл образуются как α-, так и β-формы моносахаридов (вспомните, чем они отличаются).*
Из пентоз самое важное биологическое значение имеют дезоксирибоза и рибоза (рис. 5.1). Дезоксирибоза входит в состав нуклеотидов ДНК (дезоксирибонуклеиновой кислоты).
Рибоза является компонентом нуклеотидов РНК (рибонуклеиновой кислоты) и АТФ.
*Кроме того, она входит в состав витамина B2 и ряда коферментов (например, НАД, НАДФ, ФАД, кофермента А), играющих ключевую роль в процессах клеточного дыхания, брожения, фотосинтеза и др.*
*К пятиуглеродным сахарам относится также рибулоза. Производные этого моносахарида участвуют в важных биохимических процессах.
Так, рибулозо-5-фосфат является одним из промежуточных продуктов биологического окисления глюкозы.
Рибулозо-1,5-дифосфат (РДФ) служит акцептором углекислого газа в процессе фотосинтеза, что лежит в основе фиксации углерода, необходимого для синтеза органических соединений автотрофными организмами.*
Для живых организмов наиболее важными гексозами являются глюкоза, галактоза и фруктоза (см. рис. 5.1). Они имеют общую формулу С6Н12О6, но различаются структурой молекул, т. е. являются изомерами.
Глюкоза — основной продукт фотосинтеза и главный источник энергии для клеток.
В живых организмах она содержится как в виде собственно моносахарида, так и в составе углеводов более сложного строения — олигосахаридов и полисахаридов. Много глюкозы присутствует в ягодах, фруктах, мёде.
В крови человека ее содержание в норме составляет около 0,1 %, этот уровень поддерживается гормонами (вспомните, какими).
Сладкие плоды растений и мёд богаты не только глюкозой, но и фруктозой. В зрелых арбузах, яблоках, грушах ее содержится примерно в 2 раза больше, чем глюкозы.
Среди всех моносахаридов фруктоза обладает самым сладким вкусом. В клетках она находится как в свободном виде, так и в составе олиго- и полисахаридов.
Галактоза также входит в состав некоторых олиго- и полисахаридов.
*Олигосахариды — соединения, состоящие из 2—10 остатков моносахаридов (одинаковых или разных). Связи между остатками моносахаридов называются гликозидными. Соединение двух моносахаридов чаще всего происходит при участии их гидроксильных групп.
При этом выделяется молекула воды, и между остатками моносахаридов формируется кислородный мостик. В некоторых случаях образование гликозидной связи происходит с участием других функциональных групп.
При этом молекулы могут соединяться, например, через атомы азота или серы.
Олигосахариды, в состав которых входят два остатка моносахаридов, называют дисахаридами.* Дисахариды, так же как и моносахариды, легко растворимы в воде и имеют сладкий вкус. К числу самых распространенных дисахаридов относятся мальтоза, лактоза и сахароза (рис. 5.2).
Мальтоза (солодовый сахар) является промежуточным продуктом ферментативного расщепления крахмала и гликогена в пищеварительной системе животных. Далее фермент мальтаза расщепляет ее до глюкозы. Гидролиз крахмала происходит и при прорастании семян растений. Особенно богаты мальтозой прорастающие зерна злаков (солод).
Лактоза (молочный сахар) — важный компонент молока. Она является главным источником энергии для детенышей млекопитающих. Сахароза (тростниковый сахар) наиболее распространена в растениях. Она служит транспортной формой продуктов фотосинтеза и может накапливаться как запасное питательное вещество.
Этот дисахарид в больших количествах содержится в побегах сахарного тростника и корнеплодах сахарной свеклы.
Полисахариды — *регулярные* биополимеры, молекулы которых состоят из большого количества (до десятков и даже сотен тысяч) моносахаридных остатков. В состав полисахарида могут входить остатки одного или разных моносахаридов. Полисахариды различаются не только составом, но и длиной полимерных цепей. Кроме того, их молекулы могут иметь линейную или разветвленную структуру.
С увеличением числа мономерных звеньев уменьшается растворимость углеводов и исчезает их сладкий вкус. Поэтому полисахариды не обладают сладким вкусом и практически нерастворимы в воде. В живой природе наиболее важную роль играют такие полисахариды как крахмал, гликоген, целлюлоза и хитин.
Крахмал представляет собой смесь полисахаридов. Примерно на 80 % (по массе) он состоит из разветвленного амилопектина и на 20 % из амилозы, имеющей линейную структуру (рис 5.3). Оба этих полисахарида образованы остатками α-глюкозы.
Крахмал откладывается в клетках растений и некоторых водорослей в качестве запасного (резервного) питательного вещества. Большое количество крахмала запасается в клубнях, плодах и семенах. Зерна злаков (риса, пшеницы, кукурузы и др.
) могут содержать до 80 % крахмала, в клубнях картофеля его массовая доля достигает 25 %.
Резервным полисахаридом животных и грибов является гликоген. У животных он откладывается преимущественно в клетках печени и мышцах. Гликоген, так же как амилоза и амилопектин, состоит из остатков α-глюкозы. Однако молекулы гликогена разветвлены сильнее, чем молекулы амилопектина (см. рис. 5.3).
Целлюлоза (клетчатка) — основной структурный компонент клеточных стенок растений и ряда водорослей. Она обладает высокой прочностью, не растворяется ни в воде, ни в органических растворителях.
Много клетчатки содержится в древесине, а в волокнах хлопчатника ее массовая доля достигает 95 %. Целлюлоза представляет собой линейный полимер (см. рис. 5.3).
*В отличие от крахмала и гликогена ее цепи построены из остатков β-глюкозы.*
*Название целлюлозы происходит от латинского слова cellula, что в переводе означает «клетка». В молекулах этого полисахарида аккумулировано около 50 % всего углерода, содержащегося в биосфере.
Среди всех органических соединений на Земле целлюлоза по массе занимает первое место. Она представляет собой почти неисчерпаемый источник глюкозы.
Однако в организме большинства животных, в том числе и человека, не синтезируются ферменты, способные расщеплять целлюлозу.
Некоторые бактерии, протисты, грибы и животные (определенные виды червей, улиток, насекомых и др.) вырабатывают фермент целлюлазу, что дает им возможность гидролизовать клетчатку до глюкозы.
Симбиотические микроорганизмы, расщепляющие целлюлозу, обитают в желудочно-кишечном тракте многих травоядных животных.
Вспомните, например, сложный желудок жвачных парнокопытных, в котором живут целлюлозоразрушающие бактерии и протисты.
В толстом кишечнике человека также присутствуют симбиотические микроорганизмы, способные расщеплять клетчатку. Однако для человека целлюлоза не является основным поставщиком глюкозы, ее роль в другом. Волокна клетчатки имеют важное значение в нашем рационе, поскольку они придают пище объем и сравнительно грубую консистенцию, что стимулирует перистальтику органов желудочно-кишечного тракта.*
Таким образом, амилопектин, амилоза, гликоген и целлюлоза являются полимерами глюкозы. Общую формулу этих полисахаридов можно записать в виде (С6Н10О5)n, где n — количество мономерных звеньев.
*Полисахарид хитин не соответствует этой формуле, т. к. его мономером является не глюкоза, а ее производное — N-ацетилглюкозамин (рис. 5.4). Следовательно, в состав хитина, кроме углерода, водорода и кислорода, входит также азот.* Это прочный полисахарид линейной структуры. Хитин является важным компонентом кутикулы членистоногих и клеточных стенок многих грибов.
*Важную роль в жизни растений играет полисахарид каллоза, которая откладывается на поперечных перегородках между ситовидными трубками.
К концу вегетационного периода ее количество увеличивается, в результате чего ситовидные трубки закупориваются и перестают функционировать.
Также каллоза синтезируется в различных органах растений в ответ на механическое повреждение или проникновение патогенных микроорганизмов.
Полисахарид инулин примечателен тем, что является полимером фруктозы. Он откладывается про запас в корнях и клубнях некоторых растений (например, георгина, цикория, топинамбура, одуванчика, нарцисса), где его содержание может достигать 12 %.*
*Молекулы полисахаридов могут приобретать определенную пространственную конфигурацию. Так, цепочки амилозы закручиваются в спирали, каждый виток которых содержит по шесть остатков глюкозы.
Молекулы амилопектина также приобретают спиральную форму, но не на всем своем протяжении, а лишь на неразветвленных участках. В точках ветвления образованию спирали препятствуют боковые цепи.
По этой причине спиральная конфигурация не характерна для такого сильно разветвленного полисахарида, как гликоген.
Спирали амилозы и амилопектина имеют внутреннюю полость, в которую могут проникать молекулы воды и других веществ. Молекулы йода по своим размерам очень точно соответствуют этим полостям.
Проникая в них, йод образует с амилозой и амилопектином соединения сложного строения, имеющие характерную окраску (синюю — с амилозой, фиолетовую — с амилопектином).
На этом основана качественная реакция на крахмал.
В молекулах, образованных остатками α-моносахаридов, наблюдается свободное вращение вокруг гликозидных связей. В цепочках целлюлозы, образованных β-глюкозой, вращение вокруг гликозидных связей ограничено.
Это создает благоприятные условия для формирования множества водородных связей между молекулами целлюлозы.
В результате они располагаются параллельно друг другу и объединяются в прочные фибриллы — волокна, составляющие каркас клеточной стенки растений.
Сходная конфигурация характерна и для хитина. Его параллельные цепи также соединяются межмолекулярными водородными связями, что приводит к формированию фибрилл.*
Углеводы способны образовывать соединения с другими органическими веществами, например с белками — гликопротеины, с липидами — гликолипиды и т. д.
*Основу клеточной стенки большинства бактерий составляет пептидогликан муреин. Линейные цепи муреина состоят из чередующихся остатков двух производных глюкозы — N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединенных гликозидными связями.
При этом параллельно расположенные полисахаридные цепи сшиваются друг с другом короткими пептидными мостиками между остатками N-ацетилмурамовой кислоты (рис. 5.5).
Благодаря поперечным сшивкам молекула муреина представляет собой трехмерную сеть, своего рода мешок, окружающий бактериальную клетку.*
*Действие ряда антибактериальных средств основано на разрушении структуры муреина или подавлении его синтеза. Например, лизоцим расщепляет гликозидные связи между остатками N-ацетилглюкозамина и N-ацетилмурамовой кислоты, что в итоге вызывает гибель бактерий.*