Белки – полимеры, мономерами которых являются аминокислоты.
Среди органических веществ белки занимают первое место по количеству и по значению. В организме человека встречаются 5 млн разнообразных белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения они построены всего из 20 различных аминокислот.
Строение аминокислоты:
В левой части молекулы расположены группа H2N–, которая обладает свойствами основания; справа – группа –COOH – кислотная, характерная для всех органических кислот.
Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп.
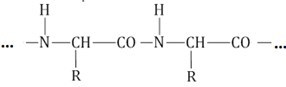
Такие связи называются ковалентными, а в данном случае – пептидными связями:
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, – полипептидом.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация.
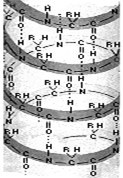
Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали (α-структура) или складчатого слоя – «гармошки» (β-структура). Это вторичная структура белка.
Но и ее часто недостаточно для приобретения характерной биологической активности.
Часто только молекула, обладающая третичной структурой, может выполнять роль катализатора или любую другую. Третичная структура образуется благодаря взаимодействию радикалов, в частности радикалов аминокислоты цистеина, которые содержат серу.
Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, соединяются, образуя так называемые дисульфидные, или S–S, связи.
Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы. Способ укладки полипептидных спиралей в глобуле называют третичной структурой белка.
Многие белки, обладающие третичной структурой, могут выполнять свою биологическую роль в клетке. Однако для осуществления некоторых функций организма требуется участие белков с еще более высоким уровнем организации.
Такую организацию называют четвертичной структурой. Присутствует не у всех белков. Она представляет собой функциональное объединение нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин.
Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий два компонента. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты.
Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо.
Строение белковой молекулы: А – первичная; Б – вторичная; В – третичная; Г – четвертичная структура
Строение молекулы гемоглобина
Гемоглобин – белок четвертичной структуры. В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем. Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Свойства белка
Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств:
- Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
- Белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
- Белки термолабильны, то есть проявляют свою активность в узких температурных рамках.
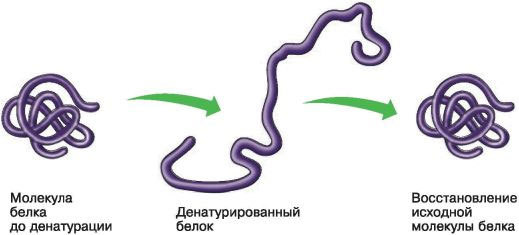
Денатурация и ренатурация белков
Денатурация – это утрата белковой молекулой своей структурной организации: четвертичной, третичной, вторичной, а при более жестких условиях – и первичной структуры. В результате денатурации белок теряет способность выполнять свою функцию.
Причинами денатурации могут быть высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей, тяжелых металлов и органических растворителей.
Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается структура белка и его функциональная активность. Такой процесс носит название ренатурации.
- Функции белков
- 1. Каталитическая (ферментативная) функция:
Многие белки являются ферментами. Ферменты — это биологические катализаторы, т. е. вещества, ускоряющие протекание химических реакций в живых организмах. Ферменты участвуют в процессах синтеза и расщепления различных веществ. Они обеспечивают фиксацию углерода в процессе фотосинтеза, расщепление питательных веществ в пищеварительном тракте и т. д.
2. Транспортная функция
Многие белки способны присоединять и переносить различные вещества. Гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из нее.
3. Защитная функция
Белки предохраняют организм от вторжения чужеродных организмов и от повреждений. Так, в ответ на проникновение чужеродных объектов (антигенов) определенные лейкоциты вырабатывают специфические белки — иммуноглобулины (антитела), участвующие в иммунном ответе организма. Белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
4. Двигательная (сократительная) функция
Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Так, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения.
5. Структурная (строительная, пластическая) функция
Белки входят в состав всех клеток и тканей живых организмов. Белки являются обязательным компонентом всех клеточных мембран и органоидов клетки. Из белков построены элементы цитоскелета, сократительные элементы мышечных волокон.
Преимущественно из белков состоят хрящи и сухожилия. В их состав входит белок коллаген. Важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт у животных является белок кератин.
В состав связок, стенок артерий и лёгких входит структурный белок эластин.
6. Сигнальная (рецепторная) функция
Некоторые белки клеточных мембран способны изменять свою структуру в ответ на действие внешних факторов. С помощью этих белков происходит прием сигналов из внешней среды и передача информации в клетку.
7. Регуляторная функция
Некоторые белки являются гормонами. Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
- 8. Запасающая (питательная) функция
- В семенах растений запасаются резервные белки, которые используются при прорастании зародышем.
- 9. Энергетическая функция
При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и жиров.
Белки
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями.
Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Макромолекулы белков имеют стереорегулярное строение, исключительно важное для проявления ими определенных биологических свойств.
| Первичная структура — последовательность α-аминокислотных звеньев в полипептидной цепи | Вторичная структура – спиральная структура полипептидной цепи, закрепленная водородными связями между группами N-H и С=О |
| Третичная структура – определенная форма спирали в пространстве, образованная с помощью дисульфидных мостиков -S-S-, водородных связей и других взаимодействий | Четвертичная структура — объединение нескольких белковых макромолекул в так называемые глобулы (бывает не у всех белков) |
Качественные реакции на белки
- Биуретовая реакция – фиолетовое окрашивание при действии на белки свежеосажденного гидроксида меди (II).
Видеоопыт взаимодействия белка с гидроксидом меди (II) можно посмотреть здесь.
- Ксантопротеиновая реакция – желтое окрашивание при действии на белки концентрированной азотной кислоты.
Видеоопыт взаимодействия белка с концентрированной азотной кислотой можно посмотреть здесь.
Денатурация белка
- Это разрушение структуры белка при нагревании, изменении кислотности среды, действии излучения, спирта, тяжелых металлов, радиации.
- Пример денатурации — свертывание яичных белков при варке яиц.
- Видеоопыт денатурации белка можно посмотреть здесь.
- Денатурация бывает обратимой и необратимой.
- При обратимой денатурации первичная структура белка не разрушается.
- Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
- При необратимой денатурации происходит также гидролиз белка — необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот или более коротких пептидных фрагментов.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Структура белка – основные виды с описанием и примерами, функции
Структура белка необычайно важна для соединений, так как все функции они выполняют, принимая определённую пространственную конфигурацию.
Белки – это природные полимеры, молекулы которых состоят из остатков аминокислот, соединенных амидными (пептидными) связями.
Мономерами для образования макромолекулы служат α-аминокислоты. Это соединения, содержащие аминогруппу у первого атома углерода, не считая углерод карбоксильной группы.
Таких аминокислот известно 20. Из этого количества создаётся всё многообразие белков. Некоторые аминокислоты могут образовываться в организме, их называют заменимыми. Те, которые поступают только с пищей – незаменимые. В зависимости от состава, белки делят на полноценные, содержащие незаменимые аминокислоты, и неполноценные, не содержащие незаменимые аминокислоты.
Состав, строение и функции белков очень сложные, изучает эти вопросы биология. Рассматриваются природные полимеры и в курсе химии. Состав их можно выразить формулой:
(–HN – CHR – CO –)n
В природные полимеры входят химические элементы: углерод, кислород, водород, азот, сера. В состав некоторых соединений включены фосфор, селен железо, медь и прочие элементы.
Первичная структура белка
Последовательно соединенные друг с другом аминокислотные остатки в цепь образуют первичную структуру. Цепь образована пептидной химической связью. Этот уровень организации самый важный. Случайная замена одной аминокислоты вызывает тяжелое генетическое заболевание.
Белковые молекулы образуются в процессе биосинтеза на рибосомах. Здесь реализуется наследственная информация. Последовательность аминокислотных остатков определяется последовательностью нуклеотидов в и-РНК. Зависимость триплетов и аминокислот записана в таблице генетического кода.
Если первичный уровень организации белка задаётся правильно, остальные структуры макромолекула принимает самопроизвольно.
Вторичная структура белка
Свёрнутая в спираль одна или 2 полипептидные цепи образуют вторичную структуру. Её поддерживают водородные связи.
Большинство белковых молекул имеют вторичный уровень.
Третичная структура белка
Упаковка вторичной структуры в клубок образует третичный уровень организации.
Поддерживают данную структуру дисульфидные, солевые, сложноэфирные мостики, силы электростатического взаимодействия.
Четвертичная структура белка
Некоторые белковые единицы формируют сложные агрегаты в пространстве. Несколько упакованных в клубок белков, ориентированных относительно друг друга, создают четвертичную структуру.
Удерживаются такие агрегаты водородными связями, электростатическими и прочими взаимодействиями.
Денатурация и ренатурация белка
Природные соединения проявляют разные свойства. Одно из важнейших свойств – денатурация белка. Это разрушение пространственной организации белковых молекул. Последовательность соединения аминокислот, а значит и химический состав, не изменяется.
Пространственная конфигурация может разрушаться в результате действия разных факторов:
- высокой температуры;
- радиации;
- солей тяжёлых металлов;
- щелочей;
- кислот;
- механических и иных факторов.
Если первичный уровень организации белка не нарушен, может идти обратная реакция – ренатурация. Это восстановление пространственного строения молекулы. Не все природные полимеры способны к восстановлению пространственной организации.
Иногда денатурация протекает необратимо, хотя первичная структура не разрушается. Функции белки способны выполнять, находясь в определенной пространственной конфигурации.
Протеины – простые белки
К простым белкам относят высокомолекулярные соединения, состоящие только из остатков аминокислот. В них содержатся незаменимые и заменимые аминокислоты.
Протеины применяются в спортивной среде для восполнения белковой массы в организме. Используют протеиновый порошок для приготовления коктейля, в качестве добавки к пище.
Протеиновый порошок получают в результате переработки продуктов животного происхождения: молока, мяса, яиц, рыбы. Организм будет получать протеины, если просто употреблять в пищу указанные продукты. Усвоение их будет идти медленнее.
Протеиды – сложные белки
Сложными называют белки, содержащие небелковые по природе вещества. Так называемые простетические группы.
В соответствии с химическим составом и наличием групп их классифицируют:
- на нуклеопротеиды;
- хромопротеиды;
- липопротеиды;
- гликопротеиды и другие.
В состав протеидов входят элементы: магний, железо, медь и другие. Примером протеидов являются гемоглобин и миоглобин. Они выполняют важнейшие функции, принимают участие в обменных процессах.
Функции белков
Белки выполняют в клетках организмов важные функции:
- каталитические;
- регуляторные;
- структурные;
- двигательные;
- транспортные;
- защитные;
- запасные и другие.
Пространственная конфигурация белка оказывает существенное влияние на возможность выполнения функций.
Строение и функции белков
Определение 1
Белки – сложные органические соединения (биополимеры), в состав молекул которых входят углерод, водород, кислород и азот (иногда серы). Их мономеры – аминокислоты.
Белки играют первостепенное значение в жизни всех организмов. Они характеризуются неисчерпаемым разнообразием, которое одновременно очень специфично.
Замечание 1
Белки и нуклеиновые кислоты являются материальной основой всего богатства организмов окружающей среды. Их доля составляет 50 – 80% сухой массы клетки.
Молекулы белков похожи на длинные цепи, состоящие из 50 – 1500 остатков аминокислот, соединённых крепкой ковалентной азотно-углеродной (пептидной) связью. В результате образуется первичная структура белка – полипептидная цепь.
Замечание 2
Молекула белка – это полипептид, молекулярная масса которого составляет от 5 тыс. до 150 тыс. Бывает и больше.
Простые белки состоят лишь из аминокислот, а сложные белки, кроме аминокислот, могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), углеводы (гликопротеиды), окрашенные химические соединения (хромопротеиды) и т.п.
Все свойства клетки (химические, морфологические, функциональные) зависят от специфических белков, содержащихся в ней.
Замечание 3
Именно набор аминокислот, их количество и последовательность расположения в полипептидной цепи и определяет специфичность белка.
Замена лишь одной аминокислоты в составе белковой молекулы или изменение последовательности расположения аминокислот может привести к изменению функций белка.
Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры.
Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Пространственное расположение полипептидных цепей также определяет свойства белков. В живой клетке полипептидные цепи скрученные или согнутые, имеют вторичную или третичную структуру.
Вторичная структура представлена спирально закрученной белковой цепочкой. Витки спирали удерживаются благодаря водородным связям, образующимся между расположенными на соседних витках СО – и NH – группами.
В результате дальнейшего закручивания спирали возникает специфическая конфигурация каждого белка – третичная структура. Образуется она благодаря связям между белковыми радикалами аминокислотных остатков:
- ковалентным дисульфидным (S – S-связям) между остатками цистеина,
- водородным,
- ионными.
- гидрофобным взаимодействиям.
В количественном соотношении наиболее важными являются гидрофобные взаимодействия, вызванные тем, что неполярные боковые цепи аминокислот стремятся объединиться друг с другом, не смешиваясь с водной средой. Белок при этом свёртывается так, чтобы его гидрофобные боковые цепи были спрятаны внутри молекулы, то есть защищены от контакта с водой, а наружу, наоборот, выставлены боковые гидрофильные цепи.
Для каждого белка специфичны количество молекуламинокислот с гидрофобными радикалами и количество молекул цистеина и характер их взаимного расположения в полипептидной цепи.
Взаимное расположение групп атомов, обходимое для проявления активности белка как катализатора, его гормональных функций и др. обеспечивается сохранением определённой формы молекулы. Потому стойкость макромолекул – не случайное свойство, а один из важнейших способовстабилизации организма.
Биологическая активность белка может проявлятся лишь когда он имеет третичную структуру, потому при замене в полипептидной цепи даже одной аминокислоты могут возникнуть изменения в конфигурации белка, а его биологическая активность снизится или же исчезнет совсем.
Иногда две, три, и больше белковых молекул с третичной структурой могут объединиться в единый комплекс. Подобные образования являются четвертичной структурой белка.
Пример 1
Примером такого сложного белка является гемоглобин, который состоит из четырёх субединиц и небелковой части – гема. Он способен выполнять свои функции только в такой форме.
В четвертичной структуре белковые субединицы не связаны химически, однако вся структура достаточно крепкая благодаря действию слабых межмолекулярных сил.
Под влиянием разнообразных физических и химических факторов (обработка щелочами, кислотами, спиртом, ацетоном, влияние высоких температур и давления и пр.) третичная и четвертичная структуры белка изменяются, потому что разрываются водородные и ионные связи.
Определение 2
Денатурация – нарушение естественной (нативной) структуры белка.
При денатурации уменьшается растворимость белков, изменяется форма и размеры молекул, теряется ферментативная активность и т.п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
Замечание 4
Все особенности строения и функционирования белковой макромолекулы зависят от его первичной структуры.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
- Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.
Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Замечание 5
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Ферменти, их роль в клетке
Определение 3
Ферменты (энзимы) – это специфические белки, присутствующие во всех организмах и выполняющие функцию биологических катализаторов.
Химические реакции в живой клетке происходят при умеренной температуре нормальном давлении и в нейтральной среде.
При таких условиях течение реакций синтеза или распада веществ в клетке был быочень медленным, если бы не действие ферментов.
Ферменты ускоряют реакции за счёт снижения энергии активации не измененяя их общего результата, то есть при их наличии для придания молекулам, вступающим в реакцию, реакционной способности, необходимо значительно меньше энергии
Все процессы в живом организме прямо или косвенно происходят с участием ферментов.
Под действием ферментов составляющие компоненты пищи (белки, липиды, углеводы и др.) расщепляются до простейших соединений, а из них позже синтезируются новые, свойственные данному виду макромолекулы. Потому нарушение образования и активности ферментов часто становятся причиной тяжёлых заболеваний.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от последнего характеризируется чрезвычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует лишь на один тип связи). Этим обеспечивается тонкое регулирование всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и т. п.), происходящих в клетке и организме.
Пример 4
Фермент уреаза катализирует расщепление только одного вещества – мочевины, но не действует каталитически на структурно родственные соединения.
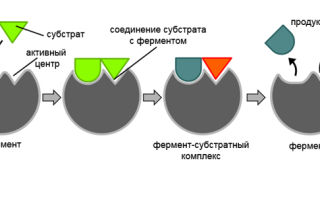
Для понятия механизма действия ферментов, которые имеют высокую специфичность, чрезвычайно важна теория активного центра.
Согласно с ней, в молекуле каждого фермента есть один или больше участков, в которых катализ происходит за счёт тесного (во многих местах) контакта между молекулами фермента и субстрата (специфического вещества), а функциональная группа (пример – ОН – группа аминокислоты серина), или же отдельная аминокислота, выступает активным центром.
- Обычно для действия катализатора необходимо, чтобы объединились несколько аминокислотных остатков, расположенных в определённой последовательности (в среднем 3 – 12).
- Активный центр также может формироваться благодаря связи ферментов с ионами металов, витаминами и другими соединениями небелковой природы – так называемыми коферментами, или кофакторами.
- Химическое строение и форма активного центра такова, что с ним способны связывать лишь определённые субстраты благодаря их идеальному соответствию (взаимодополняемости, или комплементарности) друг другу.
- Остальные аминокислотные остатки обеспечивают большой молекуле ферментп соответствующую глобулярную форму, необходимую для эффективной работы самого центра.
Кроме того, вокруг большой молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими ассиметрической формы. В результате ослабевают химические связи и начальная затрата энергии на реакцию, которая катализируется, будет меньше, а значит, значительно увеличится её скорость.
Пример 5
Одна молекула фермента каталазы способна за 1 мин расщепить более 5 млн. молекул перекиси водорода, которая возникает во время окисления в организме различных соединений.
Активный центр некоторых ферментов в присутствии субстрата может изменять конфигурацию: для обеспечения наибольшей каталитической активности такой фермент специально ориентирует свои функциональные группы.
Молекулы субстрата, присоединяясь к ферменту, также в определённых пределах изменяют свою конфигурацию для увеличения реакционной способностит функциональных групп центра.
На заключительном этапе химической реакции комплекс фермента и субстрата распадается, образуются конечные продукты и свободный фермент. Активный центр при этом освобождается и способен снова принимать новые молекулы субстрата.
Скорость реакций с участием ферментов зависит от многих факторов: от концентрации фермента, от природы субстрата, от давления, температуры, кислотности среды, от наличия ингибиторов.
При температурах, близких к 0˚С, до минимума замедляется скорость биохимических реакций. Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.
Пример 6
Для консервации органы человека (почки, серце, селезёнка, печень) перед пересадкой больному подвергают охлаждению, чтобы понизить интенсивность биохимических реакций и тем самым продлить время жизни этих органов. При быстром замораживании пищевых продуктов предотвращается размножение микроорганизмов, а так же инактивируются их ферменты, потому они уже не способны вызывать разложение пищевых продуктов.
Структура и функции белков
-
Структура белковых молекул. Связь свойств, функций и активности белков с их структурной организацией (специфичность, видовая принадлежность, эффект узнавания, динамичность, эффект кооперативного взаимодействия).
Белки —
это высокомолекулярные азотсодержащие
вещества, состоящие из остатков
аминокислот, связанных между собой
пептидными связями. Белки иначе называют
протеинами;
Простые белки
построены из аминокислот и при гидролизе
распадаются соответственно только на
аминокислоты. Сложные белки – это
двухкомпонентные белки, которые состоят
из какого-либо простого белка и небелкового
компонента, называемого простетической группой.
При гидролизе сложных белков, помимо свободных аминокислот,
освобождаются небелковая часть или
продукты ее распада.
Простые белки в
свою очередь делятся на основании
некоторых условно выбранных критериев
на ряд подгрупп: протамины, гистоны,
альбумины, глобулины, проламины, глютелины
и др.
Классификация
сложных белков основана на химической
природе входящего в их состав небелкового
компонента. В соответствии с этим
различают: фосфопротеины (содержат
фосфорную кислоту), хромопротеины (в
состав их входят пигменты), нуклеопротеины
(содержат нуклеиновые кислоты),
гликопротеины (содержат углеводы),
липопротеины (содержат липиды) и
металлопротеины (содержат металлы).
3. Структура
белка.
Последовательность расположения аминокислотных остатков
в полипептидной цепи белковой молекулы
получила название первичной
структуры белка.
Первичная структура белка, помимо
большого числа пептидных связей, обычно
содержит также небольшое число
дисульфидных (-S-S-)
связей.
Пространственная конфигурация
полипептидной цепи, точнее тип
полипептидной
спирали, определяет вторичную
структуру
белка,
она представлена в основном
α-спиралью,
которая фиксирована водородными связями.
третичная
структура
-полипептидная цепь, свернутая целиком
или частично в спираль, расположена или
упакована в пространстве (в глобуле).
Известная стабильность третичной
структуры белка обеспечивается за счет
водородных связей, межмолекулярных
ван-дер-ваальсовых сил, электростатического
взаимодействия заряженных групп и т д.
-
Четвертичная
структура белка
— структура,
состоящая из определенного числа
полипептидных цепей, занимающих строго
фиксированное положение относительно
друг друга. -
Классический
пример белка, имеющего четвертичную
структуру, являеться гемоглобин. -
Физические
свойства белков: высокая
вязкость растворов,
незначительная
диффузия,
способность
к набуханию в
больших пределах,
оптическая активность,
подвижность в электрическом
поле, низкое осмотическое давление и
высокое онкотическое давление, способность
к поглощению Уф-лучей
при 280 нм, как
и аминокислоты, амфотерны благодаря
наличию свободных NH2-и
СООН-групп и характеризуются
соответственно всеми св-вами кислот и
оснований.
Обладают явно выраженными гидрофильными
свойствами. Их растворы обладают очень
низким осмотическим давлением, высокой
вязкостью и незначительной способностью
к диффузии. Белки способны к набуханию
в очень больших пределах. С
коллоидным состоянием белков связано
явление светорассеяния, лежащее
в основе количественного определения
белков методом нефелометрии.
Белки способны
адсорбировать на своей поверхности
низкомолекулярные органические
соединения и неорганические ионы. Это
свойство предопределяет транспортные
функции отдельных белков.
Химические
свойства белков разнообразны,
поскольку боковые радикалы аминокислотных
остатков содержат различные
функциональные группы (—NH2,
—СООН, —ОН, —SН
и др.). Характерной для белков реакцией
является гидролиз пептидных связей.
Благодаря наличию и амино-, и карбоксильных
групп белки обладают амфотерными
свойствами.
Денатурация
белка —
разрушение связей, стабилизирующих
четвертичную, третичную и вторичную
структуры, приводящее к дезориентации
конфигурации белковой молекулы и
сопровождаемое потерей нативных св-в.
Различают физические
(температура, давление, механическое
воздействие, ультразвуковое и ионизирующее
излучения) и химические (тяжелые металлы,
кислоты, щелочи, органические растворители,
алкалоиды) факторы, вызывающие денатурацию.
Обратным процессом
является ренатурация,
то есть восстановление физико-химических
и биологических свойств белка. Ренатурация
невозможна если затронута первичная
структура.
Большинство
белков денатурируют
при нагревании их раствором выше 50-60о
С.
Внешние
проявления денатурации сводятся к
потере растворимости, особенно в
изоэлектрической точке, повышению
вязкости белковых растворов, увеличению
количества свободных функциональных
SH-rpyпп
и изменению характера рассеивания
рентгеновских лучей, развертываются
глобулы нативных белковых молекул и
образуются
случайные и беспорядочные структуры.
Сократительная
функция. актин и миозин –
специфические белки
мышечной ткани.
Структурная функция.
фибриллярные белки,
в частности коллаген в соединительной
ткани, кератин в
волосах, ногтях, коже,эластин в
сосудистой стенке и др.
Гормональная
функция.
Ряд гормонов представлен
белками или полипептидами,
например гормоны
гипофиза,
поджелудочной железы и др.
Некоторые гормоны являются
производными аминокислот.
Питательная
(резервная) функция.резервные
белки, являющиеся
источниками питания для плода,
Основной белок молока (казеин)
также выполняет главным образом
питательную функцию.
-
Биологические функции белков. Многообразие белков по структурной организации и биологической функции. Полиморфизм. Различия белкового состава органов и тканей. Изменения состава в онтогенезе и при заболеваниях.
-По степени
сложности
строения белки делят на простые и
сложные. Простые
или
однокомпонентные
белки
состоят только из белковой части и при
гидролизе дают аминокислоты.
К сложным
или
двухкомпонентным
относят
белки, в
состав
которых входит протеин и добавочная
группа небелковой природы, называемая
простетической.
(могут
выступать липиды, углеводы, нуклеиновые
кислоты); соответственно сложные белки
называют липопротеинами, гликопротеинами,
нук-леопротеинами.
– По форме
белковой молекулы
белки разделяют на две группы: фибриллярные
(волокнистые) и глобулярные (корпускулярные).
Фибриллярные
белки характеризуются
высоким отношением их длины к диаметру
(несколько десятков единиц).
Их молекулы
нитевидны и обычно собраны в пучки,
которые образуют волокна. (являются
главными компонентами наружного
слоя кожи, образуя защитные покровы
тела человека).
Они также участвуют в
образовании соединительной ткани,
включая хрящи и сухожилия.
Подавляющее
количество природных белков относится
к глобулярным. Для глобулярных
белков характерно
небольшое отношение длины к диаметру
молекулы (несколько единиц). Имея более
сложную конформацию, глобулярные
белки выполняют и
более
разнообразные.
-По отношению к
условно выбранным растворителям
выделяют альбумины
и глобулины.
Альбумины
очень
хорошо растворяются в
воде и в
концентрированных солевых растворах.Глобулины
не растворяются в воде и в
растворах
солей умеренной концентрации..
–Функциональная
классификация белков наиболее
удовлетворительная, поскольку в ее
основу положен не случайный признак а
выполняемая функция. Кроме того, можно
выделить сходство структур, свойств и
функциональной активности входящих в
какой-либо класс конкретных белков.
• Каталитически
активные белкиназывают
ферментами.
Они осуществляют
катализ практически всех химических
превращений в клетке. Подробно эта
группа белков будет рассмотрена в главе
4.
-
• Гормонырегулируют
обмен веществ внутри клеток и интегрируют
обмен в различных клетках организма в
целом. -
• Рецепторыизбирательно
связывают различные регуляторы (гормоны,
медиаторы) на поверхности клеточных
мембран. -
Транспортные
белкиосуществляют
связывание и транспорт веществ между
тканями и через мембраны клетки.
• Структурные
белки.
Прежде всего
к этой группе относят белки, участвующие
в построении различных биологических
мембран.
• Белки —
ингибиторы
ферментов составляют
многочисленную группу эндогенных
ингибиторов. Они осуществляют регуляцию
активности ферментов.
• Сократительные
белки обеспечивают
механический процесс сокращения с
использованием химической энергии.
• Токсичные
белки—
некоторые белки и пептиды, выделяемые
организмами (змеями, пчелами,
микроорганизмами), являющиеся ядовитыми
для других живых организмов.
• Защитные
белки.
антитела — вещества
белковой природы, вырабатываемые
животным организмом в ответ на введение
антигена. Антитела, взаимодействуя
с антигенами, дезактивируют их и тем
самым защищают организм от воздействия
чужеродных соединений, вирусов, бактерий
и т. д.
Белковый состав
зависит от физиологич. Активности,
состава пищи и режима питания, биоритмов.
В процессе развития состав меняется
значительно (от зиготы до формирования
дифференцированных органов со
специализированными ф-ми).
Например,
эритроциты содержат гемоглобин,
обеспечивающий транспорт кислорода
кровью, мыш-е кл-ки содержат сократительные
белки актин и миозин, в сетчатке-белок
родопсин и т д. При болезнях белковый
состав меняется-протеинопатии.
Наследственные протеинопатии развиваются
в результате повреждений в генетическом
аппарат.
Какой-либо белок не синтезируется
вовсе или синтезируется, но его первичная
структура изменена (серповидно-клеточная
анемия). Любая болезнь
сопровождается изменением белкового
состава т.е. развивается приобретённая
протеинопатия.
При этом первичная
структура белков не нарушается, а
происходит количественное изменение
белков, особенно в тех органах и тканях,
в которых развивается патологический
процесс. Например, при панкреатитах
снижается выработка ферментов, необходимых
для переваривания пищевых веществ в
ЖКТ.
-
Факторы повреждения структуры и функции белков, роль повреждений в патогенезе заболеваний. Протеинопатии
Белковый
состав организма здорового взрослого
человека относительно постоянен, хотя
возможны изменения количества отдельных
белков в органах и тканях.
При различных заболеваниях происходит
изменение белкового состава тканей.
Эти изменения называются протеинопатиями.
Различают наследственные и приобретённые
протеинопатии. Наследственные
протеинопатии развиваются в результате
повреждений в генетическом аппарате
данного индивидуума. Какой-либо белок
не синтезируется вовсе или синтезируется,
но его первичная структура изменена.
Любая болезнь сопровождается изменением
белкового состава организма, т.е.
развивается приобретённая протеинопатия.
При этом первичная структура белков не
нарушается, а обычно происходит
количественное изменение белков,
особенно в тех органах и тканях, в которых
развивается патологический процесс.
Например, при панкреатитах снижается
выработка ферментов, необходимых для
переваривания пищевых веществ в ЖКТ.
В
некоторых случаях приобретённые
протеинопатии развиваются в результате
изменения условий, в которых функционируют
белки. Так, при изменении рН среды в
щелочную сторону (алкалозы различной
природы) изменяется кон-формация
гемоглобина, увеличивается его сродство
к О2 и
снижается доставка О2 тканям
(гипоксия тканей).
Иногда в результате
болезни повышается уровень метаболитов
в клетках и сыворотке крови, что приводит
к модификации некоторых белков и
нарушению их функции
Кроме
того, из клеток повреждённого органа в
кровь могут выходить белки, которые в
норме определяются там лишь в следовых
количествах. При различных заболеваниях
часто используют биохимические
исследования белкового состава крови
для уточнения клинического диагноза.
4.
Первичная
структура белков. Зависимость свойств
и функций белков от их первичной
структуры. Изменения первичной структуры,
протеинопатии.