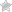Этапы синтеза белка. Транскрипция. Трансляция
Сначала, установите последовательность этапов биосинтеза белка, начиная с транскрипции. Всю последовательность процессов, происходящих при синтезе белковых молекул, можно объединить в 2 этапа:
Структурными единицами наследственной информации являются гены – участки молекулы ДНК, кодирующие синтез определенного белка.
По химической организации материал наследственности и изменчивости про- и эукариот принципиально не отличается.
Генетический материал в них представлен в молекуле ДНК, общим является также принцип записи наследственной информации и генетический код. Одни и те же аминокислоты у про — и эукариот шифруются одинаковыми кодонами.
Геном современных прокариотических клеток характеризуется относительно небольшими размерами, ДНК кишечной палочки имеет вид кольца, длиной около 1 мм. Она содержит 4 х 106 пар нуклеотидов, образующих около 4000 генов. В 1961 г. Ф. Жакоб и Ж.
Моно открыли цистронную, или непрерывную организацию генов прокариот, которые полностью состоят из кодирующих нуклеотидных последовательностей, и они целиком реализуются в ходе синтеза белков. Наследственный материал молекулы ДНК прокариот располагается непосредственно в цитоплазме клетки, где также находятся необходимые для экспрессии генов тРНК и ферменты.
Экспрессия- это функциональная активность генов, или выражение генов. Поэтому синтезированная с ДНК иРНК способна сразу выполнять функцию матрицы в процессе трансляции синтеза белка.
Геном эукариот содержит значительно больше наследственного материала. У человека общая длина ДНК в диплоидном наборе хромосом составляет около 174 см. Она содержит 3 х 109 пар нуклеотидов и включает до 100000 генов. В 1977 г.
была обнаружена прерывистость в строении большинства генов эукариот, получивший название «мозаичный» ген. Для него характерны кодирующие нуклеотидные последовательности экзонные и интронные участки. Для синтеза белка используется только информация экзонов. Количество интронов варьирует в разных генах.
Установлено,что ген овальбумина кур включает 7 интронов , а ген проколлагена млекопитающих – 50. Функции молчащей ДНК – интронов окончательно не выяснены.
Предполагают, что они обеспечивают: 1) структурную организацию хроматина; 2) некоторые из них, очевидно, участвуют в регуляции экспрессии генов; 3) интроны можно считать запасом информации для изменчивости; 4) они могут играть защитную роль, принимая на себя действие мутагенов.
Транскрипция
Процесс переписывания информации в ядре клетки с участка молекулы ДНК на молекулу мРНК (иРНК) называется транскрипция (лат. Transcriptio – переписывание). Синтезируется первичный продукт гена- мРНК. Это первый этап белкового синтеза.
На соответствующем участке ДНК фермент РНК–полимераза узнает знак начала транскрипции – промотр . Стартовой точкой считается первый нуклеотид ДНК, который включается ферментом в РНК-транскрипт. Как правило, кодирующие участки начинаются кодоном АУГ, иногда у бактерий используется ГУГ.
Когда РНК-полимераза связывается с промотором, происходит локальное расплетание двойной спирали ДНК и копируется одна из цепей по принципу комплементарности. Синтезируется мРНК, скорость сборки её достигает 50 нуклеотидов в секунду.
По мере движения РНК–полимеразы , растёт цепь мРНК, и когда фермент достигнет конца копирующего участка – терминатора, мРНК отходит от матрицы. Двойная спираль ДНК позади фермента восстанавливается.
Транскипция прокариот осуществляется в цитоплазме. В связи с тем, что ДНК целиком состоит из кодирующих нуклеотидных последовательностей, поэтому синтезированная мРНК сразу выполняет функцию матрицы для трансляции (см. выше).
Транскрипция мРНК у эукариот происходит в ядре. Она начинается синтезом больших по размерам молекул — предшественников (про-мРНК), называемых незрелой , или ядерной РНК.Первичный продукт гена- про-мРНК является точной копией транскрибированного участка ДНК, включает экзоны и интроны. Процесс формирования зрелых молекул РНК из предшественников называется процессингом.
Созревание мРНК происходит путём сплайсинга – это вырезания ферментами рестриктаз интронов и соединение участков с транскрибируемыми последовательностями экзонов ферментами лигаз. ( Рис.).Зрелая мРНК значительно короче молекул-предшественников про – мРНК, размеры интронов в них варьирует от 100 до 1000 нуклеотидов и более.
На долю интронов приходится около 80% всей незрелой мРНК.
В настоящее время доказана возможность альтернативного сплайсинга, при котором из одного первичного транскрипта могут удалятся в разных его участках нуклеотидные последовательности и будут образовываться несколько зрелых мРНК. Данный вид сплайсинга характерен в системе генов иммуноглобулинов у млекопитающих , что даёт возможность формировать на основе одного транскрипта мРНК разные виды антител.
По завершению процессинга зрелая мРНК проходит отбор перед выходом из ядра. Установлено, что в цитоплазму попадает всего 5% зрелой мРНК , а остальная часть расщепляется в ядре.
Трансляция
Трансляция (лат. Translatio — передача, перенесение) — перевод информации, заключенной в последовательности нуклеотидов молекулы мРНК ,в последовательность аминокислот полипептидной цепи (Рис. 10). Это второй этап белкового синтеза. Перенос зрелой мРНК через поры ядерной оболочки производят специальные белки, которые образуют комплекс с молекулой РНК.
Кроме транспорта мРНК , эти белки защищают мРНК от повреждающего действия цитоплазматических ферментов. В процессе трансляции центральная роль принадлежит тРНК, они обеспечивают точное соответствие аминокислоты коду триплета мРНК.
Процесс трансляции- декодирования происходит в рибосомах и осуществляется в направлении от 5 к 3 , Комплекс мРНК и рибосом называется полисомой.
В ходе трансляции можно выделить три фазы: инициацию, элонгацию и терминацию
Инициация
На этом этапе происходит сборка всего комплекса , участвующего в синтезе молекулы белка. Происходит объединение двух субъединиц рибосом на определённом участке мРНК , присоединение к ней первой аминоацил – тРНК и этим задаётся рамка считывания информации .
В молекуле любой м-РНК есть участок , комплементарный р-РНК малой субединицы рибосомы и специфически ею управляемый. Рядом с ним находится инициирующий стартовый кодон АУГ, который кодирует аминокислоту метионин.
Фаза инициации завершается образованием комплекса :рибосома, -мРНК- инициирующая аминоацил-тРНК.
Элонгация
— она включает все реакции от момента образования первой пептидной связи до присоединения последней аминокислоты. На рибосоме имеется два участка для связывания двух молекул т-РНК. В одном участке-пептидильном( П) находится первая т-РНК с аминокислотой метионин и с него начинается синтез любой молекулы белка.
Во второй участок рибосомы- аминоацильный (А ) поступает вторая молекула т-РНК и присоединяется к своему кодону. Между метионином и второй аминокислотой образуется пептидная связь. Вторая т-РНК перемещается вместе со своим кодоном м-РНК в пептидильный центр.
Перемещение т-РНК с полипептидной цепочкой из аминоацильного центра в пептидильный сопровождается продвижением рибосомы по м-РНК на шаг, соответствующий одному кодону. Т-РНК, доставившая метионин, возвращается в цитоплазму, амноацильный центр освобождается.
В него поступает новая т-РНК с аминокислотой, зашифрованной очередным кодоном. Между третьей и второй аминокислотами образуется пептидная связь и третья т-РНК вместе с кодоном м-РНК перемещается в пептидильный центр .Процесс элонгации, удлинения белковой цепи.
Продолжается до тех пор, пока в рибосому не попадёт один из трёх кодонов, не кодирующих аминокислоты. Это кодон — терминатор и для него не существует соответствущей т-РНК , поэтому ни одна из т-РНК не может занять место в аминоацильном центре.
Терминация
– завершение синтеза полипептида. Она связана с узнаванием специфическим рибосомным белком одного из терминирующих кодонов (УАА, УАГ, УГА), когда он будет входить в аминоацильный центр.
К рибосоме присоединяется специальный фактор терминации, который способствует разъединению субъединиц рибосомы и освобождению синтезированной молекулы белка.
К последней аминокислоте пептида присоединяется вода и её карбоксильный конец отделяется от т-РНК.
Сборка пептидной цепи осуществляется с большой скоростью. У бактерий при температуре 37°С она выражается в добавлении к полипептиду от 12 до 17 аминокислот в секунду. В эукариотических клетках к полипептиду добавляется две аминокислоты в одну секунду.
Синтезированная полипептидная цепь затем поступает в комплекс Гольджи, где завершается построение белковой молекулы (последовательно возникают вторая, третья, четвертая структуры). Здесь же происходит комплексование белковых молекул с жирами и углеводами.
Весь процесс биосинтеза белка представлен в виде схемы: ДНК ® про иРНК ® мРНК ® полипептидная цепь ® белок® комплексование белков и их преобразование в функционально активные молекулы.
Этапы реализации наследственной информации также протекают сходным образом: сначала она транскрибируется в нуклеотидную последовательность мРНК, а затем транслируется в аминокислотную последовательность полипептида на рибосомах с участием тРНК.
Транскрипция эукариот осуществляется под действием трех ядерных РНК-полимераз. РНК-полимераза 1 находится в ядрышках и отвечает за транскрипцию генов рРНК. РНК-полимераза 2 находится в ядерном соке и отвечает за синтез предшественника мРНК.
РНК-полимераза 3 –небольшая фракция в ядерном соке, которая осуществляет синтез малых рРНК и тРНК. РНК-полимеразы специфически узнают нуклеотидную последовательность транскрипции-промотор. Эукариотическая мРНК вначале синтезируется в виде предшественницы (про- иРНК), на нее списывается информация с экзонов и интронов.
Синтезированная мРНК обладает большими, чем необходимо для трансляции размерами и оказывается менее стабильной.
В процессе созревания молекулы мРНК с помощью ферментов рестриктаз вырезаются интроны, а с помощью ферментов – лигаз сшиваются экзоны. Созревание мРНК называется процессингом, сшивание экзонов называется сплайсингом. Таким образом, зрелая мРНК содержит только экзоны и она значительно короче её предшественницы – про- иРНК.
Размеры интронов варьируют от 100 до 10000 нуклеотидов и более. На долю интонов приходится около 80% всей незрелой мРНК. В настоящее время доказана возможность альтернативного сплайсинга, при котором из одного первичного транскрипта могут удаляться в разных его участках нуклеотидные последовательности и будут образовываться несколько зрелых мРНК.
Данный вид сплайсинга характерен в системе генов иммуноглобулинов у млекопитающих, что даёт возможность формировать на основе одного транскрипта мРНК разные виды антител. По завершению процессинга зрелая мРНК проходит отбор перед выходом в цитоплазму из ядра. Установлено, что попадает всего 5% зрелой мРНК, а остальная часть расщепляется в ядре.
Преобразование первичных транскриптонов эукариотических генов, связанное с их экзон-интронной организацией, и в связи с переходом зрелой мРНК из ядра в цитоплазму, определяет особенности реализации генетической информации эукариот.
Следовательно, мозаичный ген эукариот не является геном цистроном, так как не вся последовательность ДНК используется для синтеза белка.
Источник: https://alexmed.info/2016/06/06/1168/
Биосинтез белка в клетке — кратко и понятно
1001student.ru > Биология > Биосинтез белка в клетке — кратко и понятно
Как объяснить, кратко и понятно, что такое биосинтез белка, и какого его значение?
Если вам интересна эта тема, и вы хотели бы подтянуть школьные знания или же повторить пропуски, то эта статья создана для вас.
Что такое биосинтез белка
Сначала стоит ознакомиться с определением биосинтеза. Биосинтезом называется синтез живыми организмами природных органических соединений.
Если быть проще, то это получение различных веществ с помощью микроорганизмов. Этот процесс занимает важную роль во всех живых клетках. Не забываем и о сложном биохимическом составе.
Транскрипция и трансляция
Это два наиглавнейших шага биосинтеза.
Транскрипция с латинского означает «переписывание» – в качестве матрицы применяется ДНК, поэтому происходит синтезирование трёх видов РНК (матричной/информационной, транспортной, рибосомной рибонуклеиновых кислот). Реакция осуществляется с помощью полимеразы (РНК) и с использованием большого количества аденозинтрифосфата.
Выделают два основных действия:
- Обозначение конца и начала трансляции присоединением иРНК.
- Событие, осуществляемое благодаря сплайсингу, который в свою очередь удаляет неинформационные последовательности РНК, тем самым происходит уменьшение массы матричной рибонуклеиновой кислоты в 10 раз.
Трансляция с латинского означает «перевод» – используется иРНК в качестве матрицы, синтезируются полипептидные цепочки.
Трансляция включает в себя три этапа, которые можно было представить в виде таблицы:
- Первый этап. Инициация — формирование комплекса, который участвует в синтезе полипептидной цепочки.
- Второй этап. Элонгация — увеличение размеров этой цепи.
- Третий этап. Терминация — заключение выше упомянутого процесса.
Схема биосинтеза белка
По схеме видно, как протекает процесс.
Точкой стыковки этой схемы являются рибосомы, в которых синтезируется белок. В простой форме синтез осуществляется по схеме
ДНК > PHK > белок.
Первым начинается этап транскрипции, в котором молекула изменяется в одноцепочную информационную рибонуклеиновую кислоту (иРНК). В ней содержится информация аминокислотной последовательности белка.
Следующей остановкой иРНК будет рибосома, в которой происходит сам синтез. Происходит это путём трансляции, формирования полипептидной цепочки. После этой заурядной схемы, полученный белок транспортируется в разные места, выполняя определённые задачи.
Последовательность процессоров биосинтеза белка
Биосинтез белка – сложный механизм, который включает в себя два выше упомянутых этапа, а именно транскрипцию и трансляцию. Первым происходит транскрибируемый этап (он разделяется на два события).
После идёт трансляция, в которой участвуют все виды РНК, у каждой есть своя функция:
- Информационная – роль матрицы.
- Транспортная – добавление аминокислот, определение кодонов.
- Рибосомная – образование рибосом, которые поддерживают иРНК.
- Транспортная – синтез полипептидной цепи.
Какие компоненты клетки участвуют в биосинтезе белка
Как мы уже говорили, биосинтез разделяют на две стадии. В каждой стадии участвуют свои компоненты. На первой стадии это дезоксирибонуклеиновая кислота, информационная и транспортная РНК, нуклеотиды.
Во второй же стадии участвуют компоненты: иРНК, тРНК, рибосомы, нуклеотиды и пептиды.
Каковы особенности реакций биосинтеза белка в клетке
В список особенностей реакций биосинтеза стоит отнести:
- Использование энергии АТФ для химических реакций.
- Присутствуют ферменты, задача которых ускорять реакции.
- Реакция имеет матричный характер, так как белок синтезируется на иРНК.
Признаки биосинтеза белка в клетке
Для такого сложного процесса, конечно же, характерны различные признаки:
- Первый из них заключается в том, что присутствуют ферменты, без которых сам процесс был бы невозможен
- Задействованы все три вида РНК, из этого можно сделать вывод, что центральная роль принадлежит РНК.
- Образование молекул производится мономерами, а именно аминокислотами.
- Стоит обозначить так же, что специфичность того или иного белка ориентируется расположением аминокислот.
Заключение
Многоклеточный организм — аппарат, состоящий из разных клеточных типов, которые дифференцированы – отличаются структурой и функциями. Кроме белков, присутствуют клетки этих типов, которые синтезируют так же себе подобных, в этом заключается различие.
Источник: https://1001student.ru/biologiya/biosintez-belka.html
Синтез белков обеспечивают рибосомы
Трансляция (англ. translation – перевод) – это биосинтез белка на матрице мРНК.
После переноса информации с ДНК на матричную РНК начинается синтез белков. Каждая зрелая мРНК несет информацию только об одной полипептидной цепи. Если клетке необходимы другие белки, то необходимо транскрибировать мРНК с иных участков ДНК.
Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных белоксинтезирующих органеллах, и включает 5 ключевых элементов:
- матрица – матричная РНК,
- растущая цепь – полипептид,
- субстрат для синтеза – 20 протеиногенных аминокислот,
- источник энергии – ГТФ,
- рибосомальные белки, рРНК и белковые факторы.
Выделяют три основных стадии трансляции: инициация, элонгация, терминация.
Инициация
Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для метионина.
В начале этой стадии формируются два тройных комплекса:
- первый комплекс – мРНК + малая субъединица + ИФ-3,
- второй комплекс – метионил-тРНК + ИФ-2 + ГТФ.
После формирования тройные комплексы объединяются с большой субъединицей рибосомы. В этом процессе активно участвуют белковые факторы инициации, источником энергии служит ГТФ.
После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы.
А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК.
События стадии инициации
После присоединения большой субъединицы начинается стадия элонгации.
Элонгация
Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот, белковые факторы элонгации, ГТФ. Удлинение цепи происходит со скоростью примерно 20 аминокислот в секунду.
Элонгация представляет собой циклический процесс. Первый цикл (и следующие циклы) элонгации включает три шага:
- Присоединение аминоацил-тРНК (еще второй) к кодону мРНК (еще второму), аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ.
- Фермент пептидилтрансфераза осуществляет перенос метионина с метионил-тРНК (в П-центре) на вторую аминоацил-тРНК (в А-центре) с образованием пептидной связи между метионином и второй аминокислотой. При этом уже активированная СООН-группа метионина связывается со свободной NH2-группой второй аминокислоты. Здесь источником энергии служит макроэргическая связь между аминокислотой и тРНК.
- Фермент транслоказа перемещает мРНК относительно рибосомы таким образом, что первый кодон АУГ оказывается вне рибосомы, второй кодон (на рисунке ) становится напротив П-центра, напротив А-центра оказывается третий кодон (на рисунке ). Для этих процессов необходима затрата энергии ГТФ. Так как вместе с мРНК перемещаются закрепленные на ней тРНК, то инициирующая первая тРНК выходит из рибосомы, вторая тРНК с дипептидом помещается в П-центр.
Последовательность событий стадии элонгации
Второе повторение цикла – начинается с присоединения третьей аминоацил-тРНК к третьему кодону мРНК, аминокислота-3 становится в А-центр. Далее трансферазная реакции повторяется и образуется трипептид, занимающий А-центр, после чего он смещается в П-центр в транслоказной реакции..
В пустой А-центр входит четвертая аминоацил-тРНК и начинается третий цикл элонгации:
Образование пептидной связи при встраивании четвертой аминокислоты в пептид.
Субъединицы рибосомы, большая часть транспортных РНК и матричная РНК не показаны
Цикл элонгации (реакции 1,2,3) повторяется столько раз, сколько аминокислот необходимо включить в полипептидную цепь.
Терминация
Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот, их также называют нонсенс-кодоны. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют:
- Гидролитическое отщепление полипептида от конечной тРНК.
- Отделение от П-центра последней, уже пустой, тРНК.
- Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ.
Реакции стадии терминации
Полирибосомы
По причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее максимально эффективно, т.е. получить максимальное количество “белковых копий”.
Для достижения этой цели на каждой мРНК может располагаться не одна, а несколько рибосом, встающих последовательно друг за другом и синтезирующих пептидные цепи.
Такие образования называются полирибосомы.
Вы можете спросить или оставить свое мнение.
- ВКонтакте
Download SocComments v1.3
Источник: http://biokhimija.ru/matrichnye-biosintezy/transljacija
Биосинтез белков – трансляция
Сборка полипептидной цепи белка из составляющих ее аминокислот включает четыре стадии: активацию и отбор аминокислот; инициацию синтеза полипептидной цепи; элонгоцию (удлинение) полипептидной цепи; терминацию синтеза полипептидной цепи.
Первая стадия – активация – это превращение аминокислоты в аминоацил – тРНК.
Взаимодействие тРНК с аминокислотами – ферментативный процесс, приводящий к образованию ковалентной сложноэфирной связи между аминокислотой и тРНК.
синтетаза
Аминокислота + АТФ + т РНК–––––® Аминоацил – тРНК + АМФ+ Н4Р2О7
Известно не менее двадцати различных аминоацил – тРНК – синтетаз, каждая из которых катализирует реакцию только одной из 20 аминокислот с тРНК, соответствующей этой аминокислоте.
Каждая синтетаза высокоспецифична, в ее активном центре находится участок, комплементарный какой-то части молекулы одной из тРНК.
Это позволяет каждой синтетазе соединять определенную аминокислоту с соответствующей тРНК.
Вторая стадия синтеза белка – инициация –начинается с образования инициирующего комплекса.
Поступившая из ядра в цитоплазму мРНК соединяется с малой (40 S) субъединицей рибосомы и инициирующим ей аминоацилом – тРНК. Затем к этому комплексу присоединяется большая (60 S) субъединица рибосомы.
Инициирующий аминоацил – тРНК – содержит аминокислоту метионин – Меt – тРНК. В дальнейшем Меt – тРНК взаимодействует своим триплетом нуклеотидов, комплементарным кодом АУГ или ЦУЦ на мРНК. Эти два кодона на мРНК называют инициирующими. С одного из них начинается синтез любого белка.
Третья стадия – элонгация. Процесс элонгации начинается со связывания аминоацил – тРНК – с инициирующим комплексом, соответствующим первому кодону мРНК, следующему за инициирующим кодоном. Кодон мРНК должен спариваться с антикодоном, т.е.
с таким триплетом в молекуле тРНК, который комплементарно ему соответствует. Эта тРНК взаимодействует затем не только с мРНК, но и с определенными участками рибосомы – центрами связывания – пептидильным (донорным) и акцепторным.
В процессе связывания аминоацила – тРНК– расходуется одна молекула ГTФ. Затем начинается образование пептидной связи между инициаторным метионином из Меt-тРНК и первой в будущей полипептидной цепи аминокислотой, включенной в аминоацил-тРНК.
Образовавшийся дипептидил – тРНК – связан с кодоном, соответствующим аминокислоте, и центром связывания рибосомы.
Затем происходит транслокация – перемещение рибосомы относительно мРНК и дипептидил-тРНК. В результате этого перемещения дипептидил-тРНК оказывается в пептидильном центре рибосомы, а тРНК метионина освобождается из комплекса. На транслокацию расходуется две молекулы ГTФ.
Дальнейшее удлинение пептидной цепи происходит путем повторения этих фаз, но теперь уже присоединяется аминоацетил-тРНК, соответствующий второму коноду мРНК, в результате чего образуется трипептид и т.д.(рис 3):
Рисунок 3 – Схема действия полирибосомы, состоящей из четырех рибосом
МС– малая субчастица рибосомы (40S); БС – большая частица рибосомы (60S); РПЦ и ЗПЦ – растущая и завершенная полипептидные цепи; ИП1 и ИП2 – кодоны – инициаторы и участок, узнаваемый рРНК; Т1 и Т2 – кодоны–терминаторы, прерывающие синтез белка.
Остаток аминокислоты инициаторного метионина, участвовавший в стадии инициации и занимающий в растущей пептидной цепи N-концевое положение, отщепляется в стадии элонгации.
Следует отметить, что метионин, встраиваемый не в начало цепи (инициаторный метионин), а внутри – переносится другой тРНК.
Четвертая стадия – терминация. Удлинение пептидной цепи продолжается до тех пор, пока на пути рибосомы не встретится один из терминальных триплетов мРНК. Это триплеты УAA, УAГ или УГA, сигнализирующие окончание синтеза полипептидной цепи.
В узнавании этих терминальных конодов участвуют внерибосомные белки – факторы терминации или факторы высвобождения белка, под действием которых происходит гидролитическое расщепление связи между полипептидом и последней тРНК, и высвобождается полипептидная цепь готового белка.
После освобождения полипептидной цепи фактор высвобождения, а также мРНК диссоциируют. У растений обнаружен лишь один фактор.
Вторичная и третичная структуры белков формируются в процессе трансляции по мере удлинения пептидной цепи. Как уже отмечалось в разделе «Белки», пространственные структуры белковой молекулы определяются первичной структурой ее полипептидной цепи. В результате формирования вторичной и третичной структур образуются активные центры белков.
В то же время в процессе трансляции и после ее завершения не всегда формируется биологически активный белок. В ряде случаев сформированные молекулы белков-ферментов неактивны, и переход их в активную форму возможен после отщепления части полипептидной цепи путем частичного гидролиза.
Так, например, в созревающих семенах ферменты протеазы синтезируются в неактивной форме, они не способны гидролизовать собственные запасные белки до прохождения частичного гидролиза полипептидной цепи молекулы фермента.
Только после частичного гидролиза, в результате которого отщепляются трипептид, протеаза переходит в активную форму и начинает гидролизовать запасные белки семян. Продукты гидролиза белков поступают в прорастающий зародыш семени.
Присоединение к молекуле белка простетической группы – кофермента или металла, объединение олигомерных белков в четвертичную структуру также происходят уже после завершения процесса трансляции.
В некоторых белках после завершения синтеза полипептидной цепи происходит модификация аминокислотных остатков, например, присоединение дополнительных метильных групп, йодирование, окисление двух остатков цистеина с образованием дисульфидного мостика, гидроксилирование остатков пролина, присоединение сахаров к остатку аспарагина при образовании гликопротеинов, фосфорилирование гидроксильных групп серина или тирозина у некоторых ферментов, присоединение КоА в ацилпереносящем белке синтетазы жирных кислот.
В реальной живой клетке синтез белков протекает не на одной рибосоме, а на комплексе или кластере рибосом – полисоме. Каждая стадия трансляции (инициация, элонгация и терминация) осуществляется каждой рибосомой.
Обычно кластеры содержат от 3 до 20 рибосом, но очень большие молекулы мРНК, состоящие из тысяч нуклеотидов, могут образовывать комплексы, содержащие от 50 до 100 рибосом.
Скорость синтеза полипептида очень высока: синтез пептида из 100 аминокислот занимает около 2 минут.
Общая схема процесса синтеза белка может быть представлена в следующем виде:
Понятие о мутациях
Выше указывалось, что состав ДНК в процессе репликации не меняется. Копирование ДНК создает молекулярную основу одного из фундаментальных свойств жизни – наследственность. Противоположное свойство – изменчивость – столь же существенно, поскольку наряду с наследственностью обеспечивает возможность естественного отбора и биологической эволюции.
Молекулярную основу изменчивости организмов составляют наследственные изменения первичной структуры ДНК – мутации, которые могут происходить из-за целого ряда причин. Например, имеющиеся азотистые основания могут быть заменены другими их аналогами или вовсе выпасть из молекулы.
Совершенно очевидно, что если в результате таких ошибок образуется ДНК, не характерная для данного вида, то она после самоудвоения дает начало новым нехарактерным молекулам, что ведет к синтезу измененного «неправильного белка» или к прекращению синтеза белка, т.е. к мутациям.
Но случайные ошибки и соответственно спонтанные мутации встречаются исключительно редко. Количество мутаций можно увеличить искусственно, если подвергнуть организмы (или их клетки) действию ионизирующей радиации, действию УФ-лучей или же обработать определенными химическими веществами, которые называют мутагенами.
Мутагены – это чужеродные химические соединения увеличивающие число мутаций. Некоторые мутагены химически изменяют структуру пуринов или пиримидинов, приводя к изменению характера спаривания оснований. Сравнительно простой пример дает мутагенное превращение цитозина в урацил (окислительное дезаминирование), которое можно вызвать, действуя на клетку азотной кислотой (рис 4):
1) превращение цитозина в урацил;
2) расхождение цепей материнской ДНК и синтез на них комплементарных цепей. Одна из дочерних клеток получает ДНК с парой А–У в отличие от другой дочерней клетки, которая, как и материнская, содержит в этом месте ДНК пару Г–Ц.
Рисунок 4 – Мутация, вызванная дезаминированием цитозина
Замена нуклеотида может привести к изменению смысла кодона и, следовательно, к синтезу измененного белка. Так возникла, например, мутация, проявляющая как серповидноклеточная анемия: кодон, ответственный за включение глутаминовой кислоты в положение 6 β–цепи гемоглобина, превратился в кодон валина.
Мутации могут быть нейтральными, полезными или вредными. К нейтральным относятся такие мутации, когда замена аминокислотного остатка в белке не сказывается на его функции. Это происходит при замене одной аминокислоты на другую, сходную по свойствам, – по заряду, по гидрофобности, размерам боковой группы.
Если в результате мутации свойства белка изменяются таким образом, что особь получает преимущество для выживания, то мутация биологически полезна. Чаще всего мутации бывают вредными.
Эксперимент исследования и практический опыт показали, что случайное вмешательство в сложно организованную отлаженную эволюцией систему редко оказывалось полезной для нее, а чаще всего велика вероятность вредных последствий.
Переваривание белков
Белки, поступившие в организм с пищей, в желудочно-кишечном тракте расщепляются до аминокислот при действии группы протеолитических ферментов – пептидгидролаз(по современной номенклатуре); широко известно их тривиальное название – протеазы, или протеиназы. Эти ферменты катализируют гидролитическое расщепление пептидной связи в белках.
Протеолитические ферменты животных и человека изучены достаточно хорошо, в меньшей степени исследованы растительные протеазы.
Для протеолитических ферментов характерен ряд общих свойств и особенностей.
Ферменты, расщепляющие белки, обладают относительной субстратной специфичностью, которая определяется:
– длиной полипептидной цепи;
– структурой радикалов аминокислотных остатков, образующих гидролизуемую пептидную связь;
– положением связи в полипептиде.
Внутренние пептидные связи расщепляются эндопептидазами, концевые – экзопептидазы:
Все протеолитические ферменты синтезируются в виде неактивных предшественников, называемых зимогенами или проферментами, и таким образом клетки защищены от контакта с активной формой фермента и автолиза.
Превращение зимогена в активный фермент происходит путем необратимой ковалентной модификации зимогена за счет локального протеолиза, т.е. разрыва одной или нескольких пептидных связей и отщепления ограниченного числа аминокислотных остатков.
Это вызывает конформационные изменения в полипептиде, достаточные для формирования пространственной структуры активного центра фермента.
Расщепление пищевых белков начинается с действия протеолитического фермента – пепсина. В клетках слизистой оболочки желудка пепсин содержится в неактивной форме, называемой зимогеном – пепсиногеном.
Специализированные клетки эпителия желудка секретируют соляную кислоту, создавая в желудке кислую среду (рН~1,5-2,0).
Этот фактор имеет важное значение в переваривании белков: денатурирует белки пищи, оказывает бактерицидное действие, убивая попадающие с пищей микроорганизмы, является инициирующим фактором активации пепсиногена и превращения его в активную форму.
В кислой среде желудочного сока некоторые группы пепсиногена протонируются, изменяется его конформация, в результате чего пепсиноген приобретает протеолитическую активность.
При этом субстратом активированного пепсиногена служит тоже пепсиноген: одна молекула пепсиногена отщепляет от другой молекулы пепсиногена N – концевую часть включающую 42 аминокислотных остатка. В результате образуется фермент пепсин. Образовавшийся пепсин также может катализировать превращение пепсиногена в пепсин. В этом случае активацию можно представить как циклический процесс с механизмом обратной связи: продукт реакции пепсин ускоряет свое собственное образование.
В результате действия пепсина белки в желудке распадаются на полипептиды; свободные аминокислоты при этом практически не образуются. Пепсиннаиболее активно гидролизует пептидные связи, NH2- группа которых принадлежит ароматическим аминокислотам – тирозину, фенилаланину, триптофану.
Дальнейшее превращение высокомолекулярных пептидов и белков, не расщепленных пепсином, происходит тремя эндопептидазами, вырабатываемыми поджелудочной железой в виде предшественников – трипсиногена, химотрипсиногена и проэластазы.
Активация трипсиногена происходит при участии фермента энтеропептидазы, выделяемого клетками кишечника. Энтеропептидаза отщепляет N-концевой гексапептид трипсиногена, в результате чего происходит изменение конформации оставшейся части молекулы и формируется активный центр – получается фермент трипсин. Основное количество трипсиногена активируется трипсином путем аутокатализа.
Трипсин обладает сравнительно узкой субстратной специфичностью, разрывая пептидные связи, в образовании которых участвуют карбоксильные группы лизина и аргинина, т.е. основных аминокислот.
В поджелудочной железе синтезируется ряд химотрипсинов (a-, b-, p– химотрипсины) из двух предшественников – химотрипсиногена А и химотрипсиногена В. Активируются зимогены в кишечнике под действием активного трипсина и химотрипсина.
Рисунок 5 – Активация протеиназ в кишечнике
Химотрипсинобладает более широкой субстратной специфичностью, чем трипсин.
Он катализирует гидролиз не только пептидов, но и эфиров, амидов и других ацилпроизводных, хотя наибольшую активность он проявляет по отношению к пептидным связям, в образовании которых принимают участие карбоксильные группы ароматических аминокислот – фенилаланина, тирозина и триптофана.
В поджелудочной железе синтезируется еще одна эндопептидаза – эластаза. Название фермент получил от субстрата эластина, который он гидролизует. Эластин богат глицином и аланином, содержится в соединительной ткани. Эластаза обладает широким спектром действия, гидролизуя субстраты, не расщепляемые трипсином и химотрипсином.
В превращении нативных белков и продуктов их гидролиза в тонком кишечнике активное участие принимают экзопептидазы. Карбоксипептидазы синтезируются в неактивном состоянии в поджелудочной железе и активизируются трипсином в кишечнике.
Карбоксипептидаза А гидролизует пептидные связи С-концевых аминокислот, образованные преимущественно ароматическими аминокислотами (фенилаланин, тирозин, триптофан), а карбоксипептидаза В-связи, в образовании которых участвуют С-концевые лизин и аргинин.
Аминопептидазы вырабатываются в клетках слизистой оболочки кишечника сразу в активной форме.
Из кишечного сока выделены два типа аминопептидаз, различающиеся по субстратной специфичности – аланинаминопептидаза и лейцинаминопептидаза, первая из которых гидролизует пептидную связь, образованную N-концевым аланином, а вторая способна гидролизовать практически любую пептидную связь, образованную N-концевой аминокислотой.
Процесс переваривания пептидов, их расщепление до свободных аминокислот в тонком кишечнике завершают три- и дипептидазы.
Источник: https://megaobuchalka.ru/6/7070.html