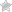Ферменты. Свойства и функции ферментов | Биология
Важнейшей функцией белков является каталитическая, ее выполняет определенный класс белков – ферменты. В организме выявлено более 2000 ферментов. Ферменты – это биологические катализаторы белковой природы, которые значительно ускоряют биохимические реакции.
Так, ферментативная реакция происходит в 100-1000 раз быстрее, чем без ферментов. Многими свойствами они отличаются от катализаторов, использующихся в химии. Ферменты ускоряют реакции при обычных условиях, в отличие от химических катализаторов.
В организме человека и животных за несколько секунд происходит сложная последовательность реакций, для проведения которой с применением обычных химических катализаторов требуется продолжительное время (дни, недели или даже месяцы).
В отличие от реакций без ферментов, в ферментативных не образуются побочные продукты (выход конечного продукта – почти 100 %). В процессе преобразований ферменты не разрушаются, поэтому небольшое их количество способно катализировать химические реакции большого количества веществ.
Все ферменты – белки и имеют характерные для них свойства (чувствительность к изменениям pH среды, денатурация при высоких температурах и т. п.).
Ферменты по химической природе разделяют на однокомпонентные (простые) и двухкомпонентные (сложные).
Однокомпонентные (простые) ферменты
Однокомпонентные ферменты состоят только из белков. К простым принадлежат преимущественно ферменты, которые осуществляют реакции гидролиза (пепсин, трипсин, амилаза, папаин и т. п.).
Двухкомпонентные (сложные) ферменты
В отличие от простых, сложные ферменты содержат небелковую часть – низкомолекулярный компонент. Белковая часть называется апоферментом (носителем фермента), небелковая – коферментом (активной или простетичной группой).
Небелковая часть ферментов может быть представлена или органическими веществами (например, производными витаминов, НАД, НАДФ, уридиновыми, цитидиловыми нуклеотидами, флавинами), или неорганическими (например, атомами металлов – железа, магния, кобальта, меди, цинка, молибдена и т. п.).
Не все необходимые коферменты могут синтезироваться организмами и потому должны поступать с пищей.
Отсутствие витаминов в пище человека и животных служит причиной потери или снижения активности тех ферментов, в состав которых они входят.
В отличие от белковой части органические и неорганические коферменты очень стойкие к неблагоприятным условиям (высокой или низкой температурам, излучению и т.п.) и могут отделяться от апофермента.
Характеризуются ферменты высокой специфичностью: могут превращать лишь соответствующие субстраты и катализировать лишь определенные реакции одного типа. Определяет ее белковый компонент, но не вся его молекула, а лишь ее небольшой участок – активный центр.
Структура его отвечает химическому строению веществ, которые вступают в реакцию. Для ферментов характерно пространственное соответствие между субстратом и активным центром. Они подходят друг другу, как ключ замку.
Активных центров может быть несколько в одной молекуле фермента. Активный центр, то есть место соединения с другими молекулами, есть не только у ферментов, а и у некоторых других белков (гем в активных центрах миоглобина и гемоглобина).
Протекают ферментативные реакции в виде последовательных этапов – от нескольких до десятков.
Активность сложных ферментов проявляется лишь тогда, когда белковая часть соединяется с небелковой. Также их активность проявляется лишь при определенных условиях: температуры, давления, pH среды и т. п. Ферменты разных организмов наиболее активны при температуре, к которой приспособлены эти существа.
Фермент-субстратный комплекс
Связи субстрата с ферментом образуют фермент-субстратный комплекс.
При этом он изменяет не только собственную конформацию, а и конформацию субстрата. Ферментативные реакции могут тормозиться собственными продуктами реакции – при накоплении продуктов скорость реакции снижается. Если продуктов реакции мало, то фермент активируется.
Вещества, проникающие в область активного центра и блокирующие каталитические группы ферментов, называются ингибиторами (от лат. inhibere – сдерживать, останавливаться). Активность ферментов снижают ионы тяжелых металлов (свинец, ртуть и т.п.).
Ферменты уменьшают энергию активации, то есть уровень энергии, необходимый для придания реакционной способности молекулам.
Энергия активации
Энергия активации – это энергия, которая расходуется на разрыв определенной связи для химического взаимодействия двух соединений. Ферменты имеют определенное расположение в клетке и организме в целом. В клетке ферменты содержатся в определенных ее частях. Многие из них связаны с мембранами клеток или отдельных органелл: митохондрий, пластид и т. п.
Биосинтез ферментов организмы способны регулировать.
Это позволяет поддерживать относительно постоянный их состав при значительных изменениях условий окружающей среды и частично видоизменять ферменты в ответ на такие изменения.
Действие разных биологически активных веществ–гормонов, лекарственных препаратов, стимуляторов роста растений, ядов и т. п. – заключается в том, что они могут стимулировать или подавлять тот или иной ферментативный процесс.
Некоторые ферменты принимают участие в активном транспорте веществ через мембраны.
Для названий большинства ферментов характерен суффикс -аз-. Его прибавляют к названию субстрата, с которым взаимодействует фермент.
Например, гидролазы – катализируют реакции расщепления сложных соединений на мономеры за счет присоединения молекулы воды в месте разрыва химической связи молекулах белков, полисахаридов, жиров; оксидредуктазы – ускоряют окислительно-восстановительные реакции (перенесение электронов или протонов); изомеразы – способствуют внутренней молекулярной перестройке (изомеризации), преобразованию изомеров и т. п.
Молекулярный уровеньУровни организации живого
Источник: https://xn—-9sbecybtxb6o.xn--p1ai/obshchaya-biologiya/fermenty-svojstva-i-funktsii-fermentov/
Что такое ферменты? Роль ферментов в организме человека :
Часто наряду с витаминами, минералами и другими полезными для организма человека элементами упоминают вещества под названием ферменты. Что такое ферменты и какую функцию в организме они выполняют, какова их природа и где они находятся?Это вещества белковой природы, биокатализаторы.
Без них не существовало бы детского питания, готовых каш, кваса, брынзы, сыра, йогурта, кефира. Они влияют на работу всех систем человеческого организма.
Недостаточная или избыточная активность этих веществ негативно сказывается на здоровье, поэтому нужно знать, что такое ферменты, чтобы избежать проблем, вызванных их нехваткой.
Что это такое?
Ферменты – это синтезирующиеся живыми клетками белковые молекулы. Их более сотни насчитывается в каждой клетке. Роль этих веществ колоссальна. Они влияют на течение скорости химических реакций при температуре, которая подходит для данного организма. Другое название ферментов – биологические катализаторы.
Увеличение скорости химической реакции происходит за счет облегчения ее протекания. Как катализаторы, они не расходуются в процессе реакции и не изменяют ее направления.
Главные функции ферментов заключаются в том, что без них очень медленно в живых организмах протекали бы все реакции, а это бы заметно сказывалось на жизнеспособности.
Например, при пережевывании продуктов, которые содержат крахмал (картофель, рис), во рту появляется сладковатый привкус, что связано с работой амилазы – фермента для расщепления крахмала, присутствующего в слюне. Сам по себе крахмал безвкусный, так как является полисахаридом. Сладкий вкус имеют продукты его расщепления (моносахариды): глюкоза, мальтоза, декстрины.
Все ферменты белков делятся на простые и сложные. Первые состоят только из белка, а вторые – из белковой (апофермент) и небелковой (кофермент) части. Коферментами могут быть витамины групп В, Е, К.
Классы ферментов
Традиционно эти вещества разделены на шесть групп. Название им первоначально давали в зависимости от субстрата, на который действует определенный фермент, путем добавления к его корню окончания –аза.
Так, те ферменты, что гидролизируют белки (протеины) стали называть протеиназами, жиры (липос) – липазами, крахмал (амилон) – амилазами.
Потом ферменты, катализирующие сходные реакции, получили названия, которые указывают на тип соответствующей реакции – ацилазы, декарбоксилазы, оксидазы, дегидрогеназы и другие. Большинство этих названий и сегодня используется.
Позже Международный биохимический союз ввел номенклатуру, согласно которой название и классификация ферментов должны соответствовать типу и механизму катализируемой химической реакции. Данный шаг принес облегчение в систематизации данных, что относятся к различным аспектам метаболизма.
Реакции и катализирующие их ферменты делятся на шесть классов. Каждый класс состоит из нескольких подклассов (4-13). Первая часть названия фермента отвечает названию субстрата, вторая – типу катализируемой реакции с окончанием –аза. У каждого фермента по классификации (КФ) есть свой кодовый номер.
Первой цифре отвечает класс реакции, следующей – подкласс и третьей – подподкласс. Четвертой цифрой обозначен номер фермента по порядку в его подподклассе. Например, если КФ 2.7.1.1, то фермент принадлежит ко 2-му классу, 7-му подклассу, 1-му подподклассу.
Последней цифрой обозначается фермент гексокиназа.
Значение
Если говорить о том, что такое ферменты, нельзя обойти стороной вопрос об их значении в современном мире. Они нашли широкое применение почти во всех отраслях деятельности человека. Такая их распространенность связана с тем, что они способны вне живых клеток сохранять свои уникальные свойства. В медицине, например, применяются ферменты групп липаз, протеаз, амилаз.
Они расщепляют жиры, белки, крахмал. Как правило, этот тип входит в состав таких лекарственных препаратов, как «Панзинорм», «Фестал». Эти средства в первую очередь используются с целью лечения заболеваний ЖКТ. Некоторые ферменты способны растворять в кровеносных сосудах тромбы, они помогают при лечении гнойных ран.
В лечении онкологических заболеваний энзимотерапия занимает особое место.
Благодаря способности расщеплять крахмал в пищевой промышленности широко используется фермент амилаза. В этой же области применяют липазы, которые расщепляют жиры и протеазы, расщепляющие белки. В пивоварении, виноделии и хлебопечении используют ферменты амилазы. В приготовлении готовых каш и для смягчения мяса применяют протеазы.
В производстве сыра используют липазы и сычужный фермент. В косметической промышленности также не обойтись без них. Они входят в состав стиральных порошков, кремов. В стиральные порошки, например, добавляют расщепляющую крахмал амилазу. Белковые загрязнения и белки расщепляются протеазами, а липазы очищают ткань от масла и жира.
Роль ферментов в организме
Два процесса отвечают в организме человека за обмен веществ: анаболизм и катаболизм. Первый обеспечивает усвоение энергии и необходимых веществ, второй – распад продуктов жизнедеятельности.
Постоянное взаимодействие этих процессов влияет на усвоение углеводов, белков и жиров и поддержание жизнедеятельности организма. Обменные процессы регулируются тремя системами: нервной, эндокринной и кровеносной.
Они могут нормально функционировать с помощью цепи ферментов, которые в свою очередь обеспечивают адаптацию человека к изменениям условий внешней и внутренней среды. В состав ферментов входит как белковая, так и небелковая продукция.
В процессе биохимических реакций в организме, в протекании которых принимают участие ферменты, сами они не расходуются. У каждого из них своя химическая структура и своя уникальная роль, поэтому каждый инициирует только определенную реакцию.
Биохимические катализаторы помогают прямой кишке, легким, почкам, печени выводить токсины и продукты жизнедеятельности из организма. Также они способствуют построению кожи, костей, нервных клеток, мышечных тканей.
Специфические ферменты используются для окисления глюкозы.
Все ферменты в организме делятся на метаболические и пищеварительные. Метаболические участвуют в нейтрализации токсинов, производстве белков и энергии, ускоряют в клетках биохимические процессы.
Так, например, супероксидисмутаза является сильнейшим антиоксидантом, который содержится в естественном виде в большинстве зеленых растений, белокочанной, брюссельской капусте и брокколи, в проростках пшеницы, зелени, ячмене.
Активность ферментов
Для того чтобы данные вещества полностью выполняли свои функции, необходимы определенные условия. На их активность влияет в первую очередь температура. При повышенной возрастает скорость химических реакций.
В результате увеличения скорости молекул у них появляется больше шансов на столкновение друг с другом, и возможность протекания реакции, следовательно, увеличивается. Оптимальная температура обеспечивает наибольшую активность.
Вследствие денатурации белков, которая происходит при отклонении оптимальной температуры от нормы, снижается скорость химической реакции. При достижении температуры точки замерзания фермент не денатурирует, но инактивируется.
Способ быстрого замораживания, который широко используют для длительного хранения продуктов, останавливает рост и развитие микроорганизмов с последующей инактивацией ферментов, которые находятся внутри. Как результат, продукты питания не разлагаются.
На активность ферментов также влияет кислотность окружающей среды. Работают они при нейтральном рН. Только некоторые из ферментов работают в щелочной, сильнощелочной, кислой или сильнокислой среде.
Например, сычужный фермент расщепляет белки в сильнокислой среде в желудке человека. На фермент могут действовать ингибиторы и активаторы. Активируют их некоторые ионы, например, металлов.
Другие ионы оказывают подавляющее действие на активность ферментов.
Гиперактивность
Избыточная активность ферментов несет свои последствия для функционирования всего организма. Во-первых, она провоцирует повышение скорости действия фермента, что в свою очередь вызывает дефицит субстрата реакции и образование избытка продукта химической реакции.
Дефицит субстратов и накопление названных продуктов заметно ухудшает самочувствие, нарушает жизнедеятельность организма, вызывает развитие заболеваний и может закончиться смертью человека. Накопление мочевой кислоты, например, приводит к возникновению подагры и почечной недостаточности. Из-за отсутствия субстрата не возникнет избытка продукта.
Это работает только в тех случаях, когда без одного и другого можно обойтись.
Причин избытка активности ферментов несколько. Первая – это мутация гена, она может быть врожденной или приобретенной под влиянием мутагенов. Второй фактор – избыток в воде или пище витамина или микроэлемента, который необходим для работы фермента. Избыток витамина С, к примеру, через повышенную активность ферментов синтеза коллагена нарушает механизмы заживления ран.
Гипоактивность
Как повышенная, так и пониженная активность ферментов негативно сказывается на деятельности организма. Во втором случае возможно полное прекращение активности. Это состояние резко снижает скорость химической реакции фермента. Как результат, накапливание субстрата дополняется дефицитом продукта, что приводит к серьезным осложнениям.
На фоне нарушений жизнедеятельности организма ухудшается самочувствие, развиваются заболевания, и может быть летальный исход. Накопление аммиака или дефицит АТФ приводит к смерти. Из-за накопления фенилаланина развивается олигофрения. Здесь также действует принцип, что при отсутствии субстрата фермента не возникнет накопления субстрата реакции.
Плохое влияние на организм оказывает состояние, при котором не выполняют своих функций ферменты крови.
Рассматривают несколько причин гипоактивности. Мутация генов врожденная или приобретенная – это первое. Состояние можно откорректировать с помощью генотерапии. Можно попробовать исключить из пищи субстраты отсутствующего фермента. В некоторых случаях это может помочь.
Второй фактор – отсутствие в пище витамина или микроэлемента, необходимых для работы фермента. Следующие причины – нарушенная активация витамина, дефицит аминокислот, ацидоз, появление ингибиторов в клетке, денатурация белков. Активность ферментов снижается также со снижением температуры тела.
Некоторые факторы влияют на функции ферментов всех типов, а другие – только на работу определенных.
Пищеварительные ферменты
От процесса приема пищи человек получает удовольствие и иногда игнорирует то, что главная задача пищеварения – это превращение продуктов питания в вещества, способные стать источником энергии и строительным материалом для тела, всасываясь в кишечник. Ферменты белков способствуют этому процессу.
Пищеварительные вещества вырабатываются органами пищеварения, принимающими участие в процессе расщепления пищи.
Действие ферментов нужно для того, чтобы получать необходимые углеводы, жиры, аминокислоты из пищи, что составляет необходимые питательные вещества и энергию для нормальной жизнедеятельности организма.
С целью нормализации нарушенного пищеварения рекомендуется с приемом пищи одновременно применять и необходимые белковые вещества. При переедании можно принять 1-2 таблетки после или во время еды.
В аптеках продается большое количество различных ферментных препаратов, которые способствуют улучшению процессов пищеварения. Запастись ими следует при приеме одного вида питательных веществ.
При проблемах с пережевыванием или глотанием пищи необходимо во время еды принимать ферменты.
Весомыми причинами для их использования могут быть также такие заболевания, как приобретенные и врожденные ферментопатии, синдром раздраженной толстой кишки, гепатит, холангит, холецистит, панкреатит, колит, хронический гастрит. Ферментные препараты следует принимать вместе с лекарствами, влияющими на процесс пищеварения.
Энзимопатология
В медицине есть целый раздел, который занимается поиском связи между заболеванием и отсутствием синтеза определенного фермента. Это область энзимологии – энзимопатология. Недостаточный синтез ферментов также подлежит рассмотрению.
Например, наследственное заболевание фенилкетонурия развивается на фоне потери способности клеток печени осуществлять синтез этого вещества, что катализирует превращение в тирозин фенилаланина. Симптомами данного заболевания являются расстройства психической деятельности.
Из-за постепенного накопления токсических веществ в организме больного тревожат такие признаки, как рвота, беспокойство, повышенная раздражительность, отсутствие интереса к чему-либо, выраженная усталость.
При рождении ребенка патология не проявляется. Первичную симптоматику можно заметить в возрасте от двух до шести месяцев. Второе полугодие жизни малыша характеризируется выраженным отставанием в психическом развитии.
У 60% больных развивается идиотия, менее чем 10% ограничиваются слабой степенью олигофрении. Ферменты клетки не справляются со своими функциями, но это можно поправить.
Своевременная диагностика патологических изменений способна приостановить развитие заболевание до периода полового созревания. Лечение заключается в ограничении поступления с пищей фенилаланина.
Ферментные препараты
Отвечая на вопрос о том, что такое ферменты, можно отметить два определения. Первое – это биохимические катализаторы, а второе – это препараты, которые их содержат. Они способны нормализировать состояние среды в желудке и кишечнике, обеспечить расщепление до микрочастиц конечных продуктов, улучшить процесс всасывания.
Они также препятствуют возникновению и развитию гастроэнтерологических заболеваний. Наиболее известным из ферментов является лекарственный препарат «Мезим Форте». В своем составе он имеет липазу, амилазу, протеазу, которые способствуют уменьшению болей при хроническом панкреатите.
Капсулы принимают в качестве заместительного лечения при недостаточной выработке поджелудочной железой необходимых ферментов.
Данные препараты употребляются преимущественно во время еды. Количество капсул или таблеток назначает доктор, исходя из выявленных нарушений механизма всасывания. Хранить их лучше в холодильнике.
При длительном приеме пищеварительных ферментов привыкания не возникает, и на работе поджелудочной железы это не сказывается. При выборе препарата стоит обратить внимание на дату, соотношение качества и цены.
Препараты ферментов рекомендуют принимать при хронических заболеваниях органов пищеварения, при переедании, при периодических проблемах с желудком, а также при отравлении продуктами питания.
Чаще всего доктора назначают таблетированный препарат «Мезим», который хорошо зарекомендовал себя на отечественном рынке и уверенно держит позиции. Есть и другие аналоги этого препарата, не менее известные и более чем доступные по цене. В частности, многие предпочитают таблетки “Пакреатин” или “Фестал”, обладающие теми же свойствами, что и более дорогие аналоги.
Источник: https://www.syl.ru/article/169007/new_chto-takoe-fermentyi-rol-fermentov-v-organizme-cheloveka
Коротко о ферментах
Ферменты, или энзимы (от лат. fermentum — закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых организмах, не подвергаясь при этом никаким изменениям. Вещества, оказывающие подобное действие, существуют и в неживой природе и называются атализаторами.
Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают химические реакции). Термины «фермент» и «энзим» давно используют как синонимы. Наука о ферментах называется энзимологией. Жизнедеятельность любого организма не возможна без участия ферментов.
Ферментативный катализ ускоряет прохождение всех биохимических реакций в организме и обеспечивает, таким образом, феномен жизни. Без присутствия ферментов в ходе биохимических реакций не произойдёт расщепления пищи на пять основных соединений: углеводы, жиры, белки, витамины и микроэлементы – пища останется бесполезной для организма.
Таким образом, без ферментов жизнь замедляется.
Функции ферментов и их роль в жизнедеятельности организма
- стимулируют процесс переваривания и всасывания пищи;
- активизируют метаболизм, способствуют выведению умерших клеток из организма;
- регулируют осмотическое давление, нормализуют значение рН различных сред;
- обеспечивают обмен веществ, поддерживают способность организма противостоять воспалительным процессам;
- повышают иммунитет и способность организма к самовосстановлению и саморегуляции;
- способствуют детоксикации организма, очищают лимфу и кровь.
Необходимость в ферментах для здорового функционирования организма Большинство учёных в настоящее время убеждены, что почти все болезни вызваны отсутствием или недостаточным количеством ферментов в организме.
Медицинские исследования показывают, что нарушения процесса выработки ферментов в организме обусловлены генетическими факторами. В частности, такое распространённое сейчас заболевание, как сахарный диабет, связано с тем, что поджелудочная железа недостаточно или вообще не вырабатывает фермент инсулин.
Лейкемия и другие виды рака обусловлены отсутствием или слабостью ферментативных барьеров в организме. Эти факты постепенно подтверждаются научными исследованиями. Можно сказать, что если в организме присутствует необходимое количество ферментов – не будет ста болезней.
С возрастом, по мере старения человеческого организма, выработка ферментов снижается. Организм начинает испытывать их недостаток, что отражается на протекании обменных процессов, снижается эффективность переваривания и всасывания питательных веществ, становится сложнее воздействовать на организм лекарственными препаратами, т. к.
они усваиваются недостаточно и вызывают большее количество побочных эффектов. Дополнительное поступление большого количества ферментов в организм позволит компенсировать их недостаток и все обусловленные этим последствия.
Таким образом, достаточное количество ферментов в организме является необходимым условием его здорового состояния.
Многие заболевания вызываются недостаточной выработкой ферментов, что нарушает баланс обмена веществ в организме.
Если обеспечить в дополнение к природной выработке ферментов их поступление извне, то это будет самым быстрым и лучшим способом лечения заболеваний.
Человеческий организм существует за счёт постоянного воздействия ферментов. Например, в процессе пищеварения с помощью ферментов (энзимов) происходят реакции разложения пищи на питательные вещества — белки, жиры, углеводы, витамины и микроэлементы; которые с их же помощью всасываются в кровь и разносятся ко всем органам. За счёт этого наши мышцы и кости, все органы и системы питаются, получают энергию и осуществляют функции, необходимые для поддержания организма в здоровом, активном состоянии. Не только человеческий организм, но и всё живое, между небом и землёй, существует за счёт биохимических реакций, осуществляемых с помощью ферментов. Фермент является источником жизни и здоровья любого живого организма. Роль ферментов в организме человека
Роль ферментов в поддержании жизнедеятельности организма удивительна по своей значимости. Наличие ферментов и существование всего живого — неотделимые понятия. Если количество фермента недостаточно для поддержания жизни — это означает смерть.
Появление зелёных листьев на деревьях весной, свет светлячка, любой акт жизнедеятельности человеческого тела (будь то приём пищи, прогулка по улице, пение, смех или плач) – все эти процессы обеспечиваются биохимическими реакциями и не возможны без обязательного участия ферментов. С первого дня зачатия ребёнка ферменты начинают выполнять свою роль.
Сперматозоид не сможет попасть в яйцеклетку, если ему не хватает особого фермента для растворения клеточной стенки яйцеклетки для осуществления процесса оплодотворения. Вся потребляемая нами пища проходит сложный процесс расщепления на простые элементы в желудочно-кишечном тракте под воздействием пищеварительных ферментов.
Только тогда эти питательные элементы могут попасть в кровь и разнестись ко всем органам и тканям. Попробуйте жевать кусочек хлеба в течение 2-3 минут, вы почувствуете, как он постепенно становится сладким — это потому, что под воздействием ферментов, содержащихся в слюне, крахмал расщепляется и высвобождается сладкая мальтоза.
При помощи ферментов в организме происходит не только процесс расщепления веществ, но и их синтез. Например, синтез аминокислот в молекулы белка — основного строительного материала для клеток мышц, волос и т. д.
, или превращение глюкозы в гликоген, который откладывается в печени и, в случае нехватки энергии, при помощи тех же ферментов, опять расщепляется на молекулы глюкозы, что обеспечивает в организме быстрый выброс энергии. Процесс обновления кожи также происходит за счёт ферментов, участвующих в метаболических процессах.
Если специфических для этого процесса ферментов достаточно, кожа будет нежной, блестящей и упругой. При дефиците фермента кожа становится сухой, шелушащейся, вялой. В организме человека функционирует около 4000 различных видов ферментов. В нём происходят тысячи биохимических реакций, которые в комплексе могут быть сравнимы с большим химическим заводом.
Но все эти химические реакции требуют ферментативного катализа, иначе они или не протекают или протекают очень медленно. Каждый фермент участвует в одной химической реакции. Некоторые из ферментов не могут быть синтезированы организмом.
Если в организме не хватает каких-либо ферментов, то существует опасность развития заболевания или возникновения предболезненного состояния, которое рано или поздно проявится в болезни. Поэтому, если вы хотите сохранить свою молодость, красоту и здоровье на долгие годы, необходимо обеспечивать содержание в организме достаточного количества ферментов. И если их уровень низкий, то основной источник их восполнения — ежедневный приём в виде биоактивных добавок.
Группы людей, особенно нуждающиеся в дополнительных источниках ферментов
Рассмотрим, какие группы людей особенно нуждаются в употреблении дополнительных ферментов.
- Те, кто хочет улучшить свою физическую форму, укрепить здоровье или восстановить его после болезни.
- Люди с ослабленным иммунитетом, часто подверженные инфекциям.
- Те, кто испытывает постоянную утомляемость, жалуется на отсутствие энергии, частую слабость.
- Преждевременно стареющие, немощные люди.
- Люди, страдающие хроническими заболеваниями.
- Онкобольные с различными типами рака, в до- и послеоперационный период.
- Люди, страдающие заболеваниями печени.
- Люди, предпочитающие мясную пищу.
- Люди, склонные к неврастении и другим нервно-психическим заболеваниям.
- Люди, страдающие половой дисфункцией.
- Женщины в дородовой и послеродовой период.
- Люди с нарушениями функций пищеварения.
- Вегетарианцы (пищевые добавки будут способствовать стабильности клетки).
- Люди с недостаточным телосложением, для улучшения физической формы (избыточный вес и ожирение, недостаточный вес).
- Люди с нарушениями и ограничениями в движении.
- Дети в период интенсивного роста (поскольку современные дети в большинстве своём почти не употребляют продукты, содержащие пищеварительные ферменты — липазу, амилазу и протеазу; и это является одной из главных причин детского ожирения, частых аллергий, запоров, повышенной утомляемости).
- Пожилые люди (с возрастом способность организма производить собственные ферменты уменьшается, снижается количество фермента, стимулирующего процесс «инвентаризации» в организме, именно поэтому потребление дополнительных ферментов является для них путём к долголетию).
- Пациенты с установленной ферментной дисфункцией (поскольку собственные ферментные запасы у них истощены, они особенно нуждаются в дополнительном приёме ферментов).
- Спортсмены особенно нуждаются в большом количестве дополнительных ферментов, поскольку из-за интенсивных физических нагрузок в их организме происходит ускоренный обмен веществ, а значит, и расход ферментных запасов также происходит усиленно (образно их можно сравнить со свечой, горящей с двух концов).
Источник: http://haogangweb.ru/news/Korotko-o-fermentah
Ферменты. Их роль в жизнедеятельности клетки
Ферменты (энзимы) — это специфические белки, которые присутствуют во всех живых организмах и играют роль биологических катализаторов.
Химические реакции в живой клетке протекают при определенной температуре, нормальном давлении и определенной кислотности среды. В таких условиях реакции синтеза ила распада веществ протекали бы в клетке очень медленно, если бы не подвергались воздействиям ферментов.
Все процессы в живом организме прямо или косвенно осуществляются с участием ферментов. Например, под их действием составные компоненты пищи (белки, углеводы, липиды) расщепляются до более простых соединений, из которых синтезируются новые, свойственные данному виду макромолекулы.
Поэтому нарушения образования и активности ферментов нередко ведут к возникновению тяжелых болезней.
По пространственной организации ферменты состоят из нескольких полипептидных цепей и обычно обладают четвертичной структурой.
Кроме того, ферменты в своем составе могут иметь и небелковые структуры. Белковая часть носит название апофермент, а небелковая — кофактор или кофермент (коэнзим).
Предшественниками многих коферментов являются витамины.
Ферментативный катализ подчиняется тем же законам, что и неферментативный (в химической промышленности), однако в отличие от него характеризуется высокой степенью специфичности (фермент катализирует только определенную реакцию или действует только на один тип связи).
Этим обеспечивается тонкая регуляция всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и др.), протекающих в клетке и организме.
Например, фермент уреаза катализирует расщепление лишь одного вещества — мочевины (H2N—СО—NH2 + Н2O → 2NH3 + СO2), не оказывая каталитического действия на структурно-родственные соединения.
Специфичность действия ферментов объясняет теория активного центра. Согласно ей, в молекуле каждого фермента имеется один или более участков, обеспечивающих специфическое взаимодействие фермента и вещества (субстрата). Активным центром выступает или функциональная группа (например, ОН-группа серина), или отдельная аминокислота.
Обычно же для каталитического действия необходимо сочетание нескольких (в среднем от 3 до 12) расположенных в определенном порядке аминокислотных остатков. Активный центр может также формироваться ионами металлов, витаминами и другими соединениями небелковой природы — коферментами, или кофакторами.
Под действием фермента происходит ослабление химических связей субстрата, и катализируемая реакция протекаете меньшей начальной затратой энергии, а следовательно, с большей скоростью. Например, одна молекула фермента каталазы может расщепить за 1 мин.
более 5 млн молекул пероксида водорода (H2O2), являющегося продуктом окисления в организме различных соединений.
На заключительном этапе химической реакции фермент-субстратный комплекс распадается с образованием конечных продуктов и свободного фермента, который вновь связывается с молекулами субстрата.
Скорость ферментативных реакций зависит от многих факторов: природы и концентрации фермента и субстрата, температуры, давления, кислотности среды, наличия ингибиторов и т. д. Например, при температурах, близких к нулю, скорость биохимических реакций замедляется до минимума.
Это свойство широко используется в различных отраслях народного хозяйства, особенно в сельском хозяйстве и медицине.
В частности, консервация различных органов (почки, сердце, селезенка, печень) перед их пересадкой больному происходит при охлаждении, чтобы снизить интенсивность биохимических реакций и тем самым продлить время жизни органов.
Источник: http://jbio.ru/fermenty-ix-rol-v-zhiznedeyatelnosti-kletki
Ферменты
Этот термин постоянно на слуху, правда, далеко не все понимают, что такое фермент или энзим, какие функции выполняет это вещество, а также чем отличаются ферменты от энзимов и отличаются ли вообще. Все это сейчас и узнаем.
Без этих веществ ни люди, ни животные не смогли бы переваривать пищу. А впервые к применению ферментов в быту человечество прибегло более 5 тысяч лет тому назад, когда наши предки научились хранить молоко в «посуде» из желудков животных. В таких условиях под воздействием сычужного фермента молоко превращалось в сыр.
И это только один из примеров работы энзима в качестве катализатора, ускоряющего биологические процессы. Сегодня ферменты незаменимы в промышленности, они важны для производства сахара, маргаринов, йогуртов, пива, кожи, текстиля, спирта и даже бетона.
В моющих средствах и стиральных порошках также присутствуют эти полезные вещества – помогают выводить пятна при низких температурах.
История открытия
Энзим в переводе из греческого означает «закваска». А открытию этого вещества человечество обязано голландцу Яну Баптисту Ван-Гельмонту, жившему в XVI веке. В свое время он весьма заинтересовался спиртовым брожением и в ходе исследования нашел неизвестное вещество, ускоряющее этот процесс.
Голландец назвал его fermentum, что в переводе означает «брожение». Затем, почти трема веками позже, француз Луи Пастер, также наблюдая за процессами брожения, пришел к выводу, что ферменты – не что иное, как вещества живой клетки.
А через некоторое время немец Эдуард Бухнер добыл фермент из дрожжей и определил, что это вещество не является живим организмом. Он также дал ему свое название – «зимаза». Еще несколькими годами позже другой немец Вилли Кюне предложил все белковые катализаторы разделить на две группы: ферменты и энзимы.
Причем вторым термином он предложил называть «закваску», действия которой распространяются вне живых организмов. И лишь 1897 год положил конец всем научным спорам: оба термины (энзим и фермент) решено использовать как абсолютные синонимы.
Структура: цепь из тысяч аминокислот
Все ферменты являются белками, но не все белки – ферменты. Как и другие протеины, энзимы состоят из аминокислот. И что интересно, на создание каждого фермента уходит от ста до миллиона аминокислот, нанизанных, словно жемчуг на нить.
Но эта нить не бывает ровной – обычно изогнута в сотни раз. Таким образом, создается трехмерная уникальная для каждого фермента структура.
Меж тем, молекула энзима – сравнительно крупное образование, и лишь небольшая часть его структуры, так называемый активный центр, участвует в биохимических реакциях.
Каждая аминокислота соединена с другой определенным типом химической связи, а каждый фермент имеет свою уникальную последовательность аминокислот. Для создания большинства из них используются примерно 20 видов аминовеществ. Даже незначительные изменения последовательности аминокислот могут кардинально менять внешний вид и «таланты» фермента.
Хотя при участии ферментов в природе происходит огромное количество реакций, но все они могут быть разгруппированы на 6 категорий. Соответственно, каждая из этих шести реакций протекает под влиянием определенного типа ферментов.
Реакции при участии энзимов:
- Окисление и восстановление.
Ферменты, участвующие в этих реакциях, называются оксидоредуктазами. В качестве примера можно вспомнить как, алкогольдегидрогеназы преобразуют первичные спирты в альдегид.
Ферменты, благодаря которым происходят эти реакции, называются трансферазами. Они обладают умением перемещать функциональные группы от одной молекулы к другой. Так происходит, например, когда аланинаминотрансферазы перемещают альфа-аминогруппы между аланином и аспартатом. Также трансферазы перемещают фосфатные группы между АТФ и другими соединениями, а с остатков глюкозы создают дисахариды.
Гидролазы, участвующие в реакции, умеют разрывать одинарные связи, добавляя элементы воды.
- Создание или удаление двойной связи.
Этот вид реакций негидролитическим путем происходит при участии лиазы.
- Изомеризация функциональных групп.
Во многих химических реакциях положение функциональной группы изменяется в пределах молекулы, но сама молекула состоит из того же количества и типов атомов, что были до начала реакции. Иными словами, субстрат и продукт реакции являются изомерами. Такого типа трансформации возможны под влиянием ферментов изомеразы.
- Образование одинарной связи с устранением элемента воды.
Гидролазы разрушают связь, добавляя в молекулу элементы воды. Лиазы осуществляют обратную реакцию, удаляя водную часть из функциональных групп. Таким образом, создают простую связь.
Как работают в организме
Некоторые из этих веществ помогают разрушать слишком большие молекулы на более мелкие «куски», которые организм сможет переварить. Другие наоборот связывают мелкие молекулы.
Но ферменты, говоря научным языком, обладают высокой селективностью. Это значит, что каждое из этих веществ способно ускорять только определенную реакцию. Молекулы, с которыми «работают» ферменты, называются субстратами.
Субстраты в свою очередь создают связь с частью фермента, именуемой активным центром.
Существуют два принципа, объясняющие специфику взаимодействия ферментов и субстратов. В так называемой модели «ключ-замок» активный центр фермента занимает в субстрате место строго определенной конфигурации. Согласно другой модели, оба участника реакции, активный центр и субстрат, меняют свои формы, чтобы соединиться.
По какому бы принципу ни происходило взаимодействие результат всегда одинаковый – реакция под воздействием энзима протекает во много раз быстрее. Вследствие такого взаимодействия «рождаются» новые молекулы, которые потом отделяются от фермента. А вещество-катализатор продолжает выполнять свою работу, но уже при участии других частиц.
Гипер- и гипоактивность
Бывают случаи, когда энзимы выполняют свои функции с неправильной интенсивностью. Чрезмерная активность вызывает чрезмерное формирование продукта реакции и дефицит субстрата. В результате – ухудшение самочувствия и серьезные болезни. Причиной гиперактивности энзима может быть как генетическое нарушение, так и избыток витаминов или микроэлементов, используемых в реакции.
Гипоактивность ферментов может даже стать причиной смерти, когда, например, энзимы не выводят из организма токсины либо возникает дефицит АТФ. Причиной такого состояния также могут быть мутированные гены или, наоборот, гиповитаминоз и дефицит других питательных веществ. Кроме того, пониженная температура тела аналогично замедляет функционирование энзимов.
Катализатор и не только
Сегодня можно часто услышать о пользе ферментов. Но что такое эти вещества, от которых зависит работоспособность нашего организма?
Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат.
Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться».
Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтоб снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются.
Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза.
Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Помимо этого, энзимы (липаза, амилаза, протеаза) активно применяются в медицине.
В частности, служат компонентом ферментативных препаратов, таких как «Фестал» «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка.
Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов.
Факторы, определяющие активность энзимов
Поскольку энзим способен ускорять реакции во много раз, его активность определяется так называемым числом оборотов. Этот термин обозначает количество молекул субстрата (реагирующего вещества), которую способна трансформировать 1 молекула фермента за 1 минуту. Однако существует ряд факторов, определяющих скорость реакции:
Увеличение концентрации субстрата ведет к ускорению реакции. Чем больше молекул действующего вещества, тем быстрее протекает реакция, поскольку задействовано больше активных центров. Однако ускорения возможно только до тех пор, пока не задействуются все молекулы фермента. После этого, даже повышение концентрации субстрата не приведет к ускорению реакции.
Обычно повышение температуры ведет к ускорению реакций. Это правило работает для большинства ферментативных реакций, но только до тех пор, пока температура не поднимется выше 40 градусов по Цельсию.
После этой отметки скорость реакции, наоборот, начинает резко снижаться. Если температура опустится ниже критической отметки, скорость ферментативных реакций повысится снова.
Если температура продолжает расти, ковалентные связи рушатся, а каталическая активность фермента теряется навсегда.
На скорость ферментативных реакций также влияет показатель рН. Для каждого фермента существует свой оптимальный уровень кислотности, при котором реакция проходит наиболее адекватно.
Изменение уровня рН сказывается на активности фермента, а значит, и скорости реакции. Если изменения слишком велики, субстрат теряет способность связываться с активным ядром, а энзим больше не может катализировать реакцию.
С восстановлением необходимого уровня рН, активность фермента также восстанавливается.
Ферменты для пищеварения
Ферменты, присутствующие в человеческом организме, можно разделить на 2 группы:
- метаболические;
- пищеварительные.
Метаболические «работают» над нейтрализацией токсических веществ, а также способствуют выработке энергии и белков. Ну и, конечно, ускоряют биохимические процессы в организме.
За что отвечают пищеварительные – понятно с названия. Но и здесь срабатывает принцип селективности: определенный тип ферментов влияет только на один вид пищи.
Поэтому для улучшения пищеварения можно прибегнуть к маленькой хитрости.
Если организм плохо переваривает что-то из еды, значит надо дополнить рацион продуктом, содержащим фермент, который способен расщепить трудно перевариваемую пищу.
Пищевые ферменты – катализаторы, которые расщепляют продукты питания до состояния, в котором организм способен поглощать из них полезные вещества. Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость
На этом этапе на пищу воздействует альфа-амилаза. Она расщепляет углеводы, крахмалы и глюкозу, которые содержатся в картофеле, фруктах, овощах и других продуктах питания.
Желудок
Здесь пепсин расщепляет белки до состояния пептидов, а желатиназа – желатин и коллаген, содержащиеся в мясе.
Поджелудочная железа
На этом этапе «работают»:
- трипсин – отвечает за расщепление белков;
- альфа-химотрипсин – помогает усвоению протеинов;
- эластазы – расщепляют некоторые виды белков;
- нуклеазы – помогают расщеплять нуклеиновые кислоты;
- стеапсин – способствует усвоению жирной пищи;
- амилаза – отвечает за усвоение крахмалов;
- липаза – расщепляет жиры (липиды), содержащиеся в молочных продуктах, орехах, маслах и мясе.
Тонкая кишка
Над пищевыми частицами «колдуют»:
- пептидазы – расщепляют пептидные соединения к уровню аминокислот;
- сахараза – помогает усваивать сложные сахара и крахмалы;
- мальтаза – расщепляет дисахариды к состоянию моносахаридов (солодовый сахар);
- лактаза – расщепляет лактозу (глюкозу, содержащуюся в молочных продуктах);
- липаза – способствует усвоению триглицеридов, жирных кислот;
- эрепсин – воздействует на протеины;
- изомальтаза – «работает» с мальтозой и изомальтозой.
Толстый кишечник
Здесь функции ферментов выполняют:
- кишечная палочка – отвечает за переваривание лактозы;
- лактобактерии – влияют на лактозу и некоторые другие углеводы.
Кроме названных энзимов, существуют еще:
- диастаза – переваривает растительный крахмал;
- инвертаза – расщепляет сахарозу (столовый сахар);
- глюкоамилаза – превращает крахмал в глюкозу;
- альфа-галактозидаза – способствует перевариванию бобов, семян, соевых продуктов, корневых овощей и листовых;
- бромелайн – фермент, полученный из ананасов, способствует расщеплению разных видов белков, эффективен при разных уровнях кислотности среды, обладает противовоспалительными свойствами;
- папаин – фермент, выделенный из сырой папайи, способствует расщеплению мелких и крупных протеинов, эффективен в широком диапазоне субстратов и кислотности.
- целлюлаза – расщепляет целлюлозу, растительные волокна (в человеческом организме не обнаружена);
- эндопротеаза – расщепляет пептидные связи;
- экстракт бычьей желчи – энзим животного происхождения, стимулирует моторику кишечника;
- панкреатин – фермент животного происхождения, ускоряет переваривание жиров и белков;
- панкрелипаза – животный фермент, способствует усвоению белков, углеводов и липидов;
- пектиназа – расщепляет полисахариды, содержащиеся во фруктах;
- фитаза – способствует усвоению фитиновой кислоты, кальция, цинка, меди, марганца и других минералов;
- ксиланаза – расщепляет глюкозу из зерновых.
Катализаторы в продуктах
Ферменты имеют решающее значение для здоровья, поскольку помогают организму расщеплять пищевые компоненты до состояния, пригодного для использования питательных веществ. Кишечник и поджелудочная железа производят широкий спектр ферментов. Но кроме этого, многие их полезных веществ, способствующих пищеварению, содержатся также и в некоторых продуктах.
Ферментированные продукты являются практически идеальным источником полезных бактерий, необходимых для правильного пищеварения. И в то время, когда аптечные пробиотики «работают» только в верхнем отделе пищеварительной системы и часто не добираются до кишечника, эффект от ферментативных продуктов ощущается во всем желудочно-кишечном тракте.
Например, абрикосы содержат в себе смесь полезных энзимов, в том числе инвертазу, которая отвечает за расщепление глюкозы и способствует быстрому высвобождению энергии.
Натуральным источником липазы (способствует более быстрому перевариванию липидов) может послужить авокадо. В организме это вещество производит поджелудочная железа. Но дабы облегчить жизнь этому органу, можно побаловать себя, например, салатом с авокадо – вкусно и полезно.
Кроме того, что банан, пожалуй, самый известный источник калия, он также поставляет в организм амилазу и мальтазу. Амилаза содержится также в хлебе, картофеле, крупах. Мальтаза способствует расщеплению мальтозы, так называемого солодового сахара, который в обилии представлен в пиве и кукурузном сиропе.
Другой экзотический фрукт – ананас содержит в себе целый набор энзимов, в том числе и бромелайн. А он, согласно некоторым исследованиям, еще и обладает противораковыми и противовоспалительными свойствами.
Экстремофилы и промышленность
Живые организмы, а также ферменты, позволяющие им функционировать, были найдены в гейзерах, где температура близка к точке кипения, и глубоко во льдах, а также в условиях крайней солености (Долина Смерти в США).
Кроме того, ученые находили энзимы, для которых уровень рН, как оказалось, также не принципиальное требование для эффективной работы. Исследователи с особым интересом изучают ферменты-экстремофилы, как вещества, которые могут быть широко использованы в промышленности.
Хотя и сегодня энзимы уже нашли свое применение в индустрии как биологически и экологически чистые вещества. К применению энзимов прибегают в пищевой промышленности, косметологии, производстве бытовой химии.
Более того, «услуги» ферментов в таких случаях обходятся дешевле, чем синтетических аналогов. Кроме того, натуральные вещества являются биоразлагаемыми, что делает их использование безопасным для экологии.
В природе существуют микроорганизмы, способные расщепить ферменты на отдельные аминокислоты, которые затем становятся компонентами новой биологической цепочки. Но это, как говорится, уже совсем другая история.
Источник: https://FoodandHealth.ru/komponenty-pitaniya/fermenty/